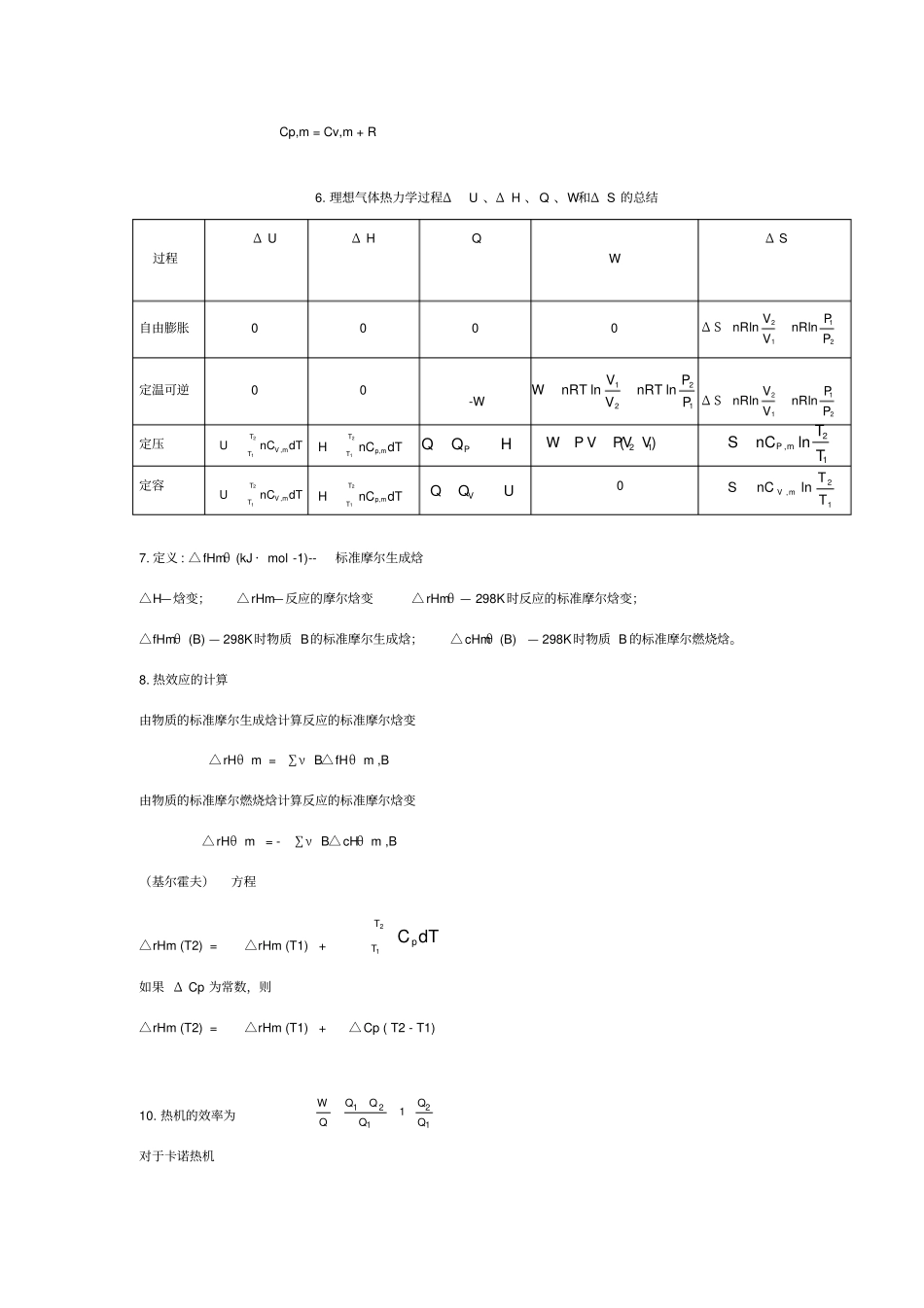
物化公式归纳第一章化学热力学基础公式总结1. 体积功We = -Pe△V2.热力学第一定律的数学表达式△ U = Q + W3. n mol 理想气体的定温膨胀过程途径 1 : 向真空膨胀Pe = 0 ,W1=0 途径 2: 一次恒外压膨胀 Pe = P2 途径 3: 无限缓慢膨胀 Pe = P1 - dP=P . 定温可逆时 :Wmax=-Wmin= 4. 焓定义式 H = U + PV在封闭体系中, W′= 0 ,体系发生一定容过程Qv = △ U 在封闭体系中, W′= 0 ,体系发生一定压过程Qp = H2 – H1 = △H 5. 摩尔热容 Cm ( J · K- 1· mol -1 ): 定容热容 CV (适用条件 : 封闭体系、无相变、无化学变化、 W′=0 定容过程适用对象 : 任意的气体、液体、固体物质)定压热容 Cp (适用条件 : 封闭体系、无相变、无化学变化、 W′=0 的定压过程适用对象 : 任意的气体、液体、固体物质)单原子理想气体: Cv,m = , Cp,m = 双原子理想气体: Cv,m = , Cp,m = 多原子理想气体: Cv,m = 3R , Cp,m = 4R1221lnlnPPnRTVVnRT)(1222VVPW12213lnlnPPnRTVVnRTWnCCm21,TTmV dTnCUCp,m = Cv,m + R 6. 理想气体热力学过程ΔU 、Δ H 、 Q 、W和Δ S 的总结过程Δ UΔ HQWΔ S自由膨胀0000定温可逆00-W定压定容07. 定义 : △ fHmθ (kJ · mol -1)-- 标准摩尔生成焓△H—焓变;△ rHm—反应的摩尔焓变△ rHmθ — 298K时反应的标准摩尔焓变;△fHmθ (B) — 298K时物质 B的标准摩尔生成焓;△ cHmθ (B) — 298K时物质 B 的标准摩尔燃烧焓。8. 热效应的计算由物质的标准摩尔生成焓计算反应的标准摩尔焓变△ rHθ m = ∑ν B△ fHθ m ,B 由物质的标准摩尔燃烧焓计算反应的标准摩尔焓变△ rHθ m = -∑ν B△ cHθ m ,B (基尔霍夫)方程△rHm (T2) = △rHm (T1) +如果 Δ Cp 为常数,则△rHm (T2) = △rHm (T1) + △ Cp ( T2 - T1)10. 热机的效率为对于卡诺热机2112lnlnPPnRVVnRΔ S21,TTmp dTnCH21,TTmVdTnCUHQQP)(12 VVPVPW12, lnTTnCSmPUQQV12,lnTTnCSmV21,TTmVdTnCU21,TTmp dTnCH2112lnlnPPnRVVnRΔ S1221lnlnPPnRTVVnRTWdTC pTT21121211QQQQQQW = 可逆循环过程 < 不可逆循环过程11. 熵变定义式 (体系经历一可逆过程的热温商之和等于该过程的熵变.)12. 热力学第二定律的数学表达式 (不等式中 , “ > ”号表示不可逆过程,...