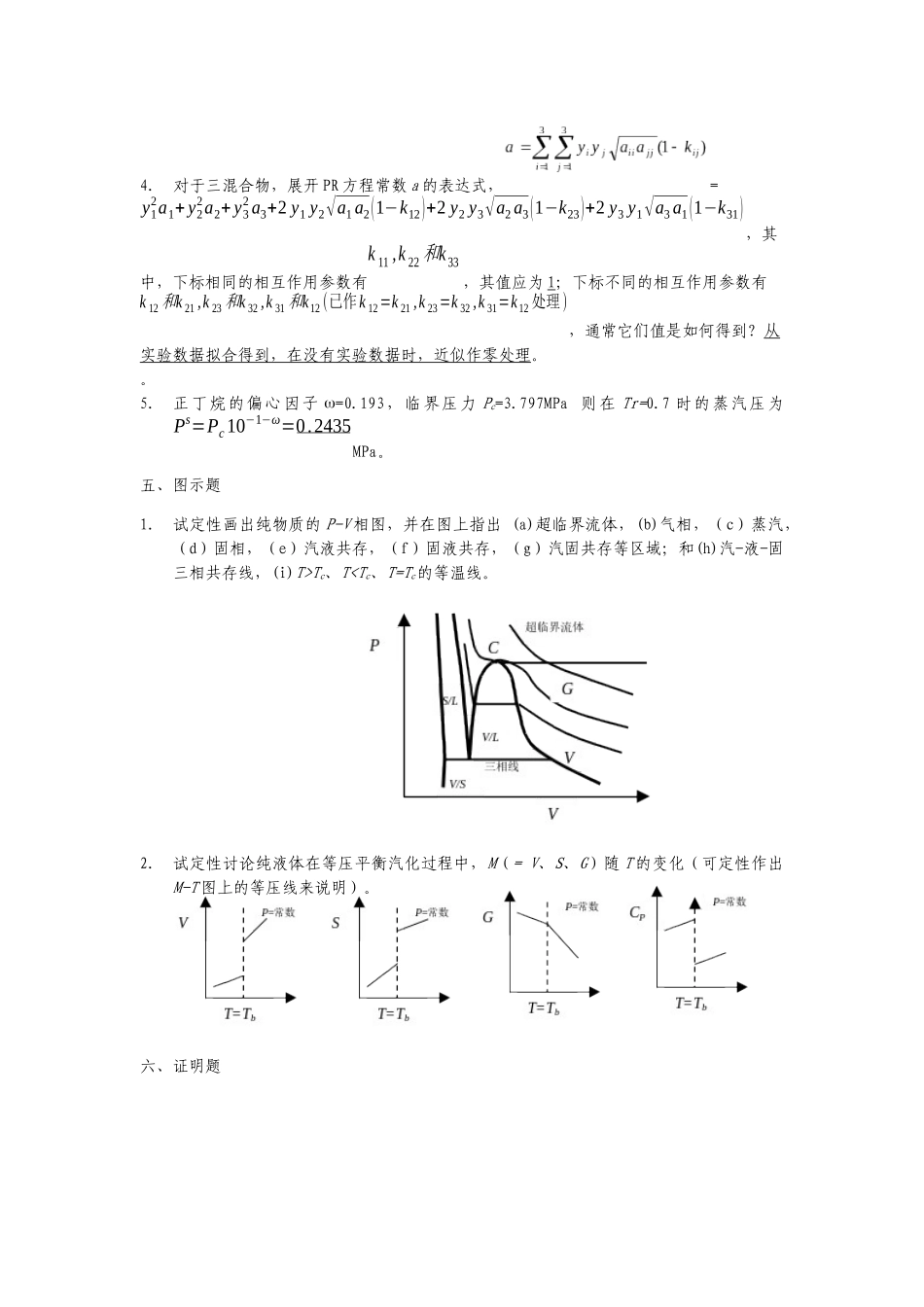
化工热力学课后答案(填空、判断、画图)第1章绪言一、是否题1.封闭体系的体积为一常数。(错)2.封闭体系中有两个相α,β。在尚未达到平衡时,α,β两个相都是均相敞开体系;达到平衡时,则α,β两个相都等价于均相封闭体系。(对)3.理想气体的焓和热容仅是温度的函数。(对)4.理想气体的熵和吉氏函数仅是温度的函数。(错。还与压力或摩尔体积有关。)5.封闭体系的1mol气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相等,初态和终态的温度分别为T1和T2,则该过程的;同样,对于初、终态压力相等的过程有。(对。状态函数的变化仅决定于初、终态与途径无关。)二、填空题1.状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态。2.封闭体系中,温度是T的1mol理想气体从(Pi,Vi)等温可逆地膨胀到(Pf,Vf),则所做的功为Wrev=RTln(Vi/Vf)(以V表示)或Wrev=RTln(Pf/Pi)(以P表示)。3.封闭体系中的1mol理想气体(已知CPig),按下列途径由T1、P1和V1可逆地变化至P2,则A等容过程的W=0,Q=(CPig−R)(P2P1−1)T1,DU=(CPig−R)(P2P1−1)T1,DH=CPig(P2P1−1)T1。B等温过程的W=−RTlnP1P2,Q=RTlnP1P2,DU=0,DH=0。第2章P-V-T关系和状态方程一、是否题1.纯物质由蒸汽变成液体,必须经过冷凝的相变化过程。(错。可以通过超临界流体区。)2.当压力大于临界压力时,纯物质就以液态存在。(错。若温度也大于临界温度时,则是超临界流体。)3.由于分子间相互作用力的存在,实际气体的摩尔体积一定小于同温同压下的理想气体的摩尔体积,所以,理想气体的压缩因子Z=1,实际气体的压缩因子Z<1。(错。如温度大于Boyle温度时,Z>1。)4.纯物质的三相点随着所处的压力或温度的不同而改变。(错。纯物质的三相平衡时,体系自由度是零,体系的状态已经确定。)5.在同一温度下,纯物质的饱和液体与饱和蒸汽的吉氏函数相等。(对。这是纯物质的汽液平衡准则。)6.纯物质的平衡汽化过程,摩尔体积、焓、热力学能、吉氏函数的变化值均大于零。(错。只有吉氏函数的变化是零。)7.气体混合物的virial系数,如B,C…,是温度和组成的函数。(对。)C绝热过程的W=−(CPig−R)P1V1R[(P2P1)RCPig−1],Q=0,DU=(CPig−R)P1V1R[(P2P1)RCPig−1],DH=CPig[(P2P1)RCPig−1]T1。4.1MPa=106Pa=10bar=9.8692atm=7500.62mmHg。5.普适气体常数R=8.314MPacm3mol-1K-1=83.14barcm3mol-1K-1=8.314Jmol-1K-1=1.980calmol-1K-1。三、填空题1.表达纯物质的汽平衡的准则有Gsv(T)=Gsl(T)G或(T,Vsv)=G(T,Vsl)(吉氏函数)、(Claperyon方程)、∫VslVsvP(T,V)dV=Ps(Vsv−Vsl)(Maxwell等面积规则)。它们能(能/不能)推广到其它类型的相平衡。2.Lydersen、Pitzer、Lee-Kesler和Teja的三参数对应态原理的三个参数分别为Tr,Pr,Zc、Tr,Pr,ω、Tr,Pr,ω和Tr,Pr,ω。3.对于纯物质,一定温度下的泡点压力与露点压力相同的(相同/不同);一定温度下的泡点与露点,在P-T图上是重叠的(重叠/分开),而在P-V图上是分开的(重叠/分开),泡点的轨迹称为饱和液相线,露点的轨迹称为饱和汽相线,饱和汽、液相线与三相线所包围的区域称为汽液共存区。纯物质汽液平衡时,压力称为蒸汽压,温度称为沸点。4.对于三混合物,展开PR方程常数a的表达式,=y12a1+y22a2+y32a3+2y1y2√a1a2(1−k12)+2y2y3√a2a3(1−k23)+2y3y1√a3a1(1−k31),其中,下标相同的相互作用参数有k11,k22k和33,其值应为1;下标不同的相互作用参数有k12k和21,k23k和32,k31k和12(已作k12=k21,k23=k32,k31=k12处理),通常它们值是如何得到?从实验数据拟合得到,在没有实验数据时,近似作零处理。。5.正丁烷的偏心因子w=0.193,临界压力Pc=3.797MPa则在Tr=0.7时的蒸汽压为Ps=Pc10−1−ω=0.2435MPa。五、图示题1.试定性画出纯物质的P-V相图,并在图上指出(a)超临界流体,(b)气相,(c)蒸汽,(d)固相,(e)汽液共存,(f)固液共存,(g)汽固共存等区域;和(h)汽-液-固三相共存线,(i)T>Tc、T