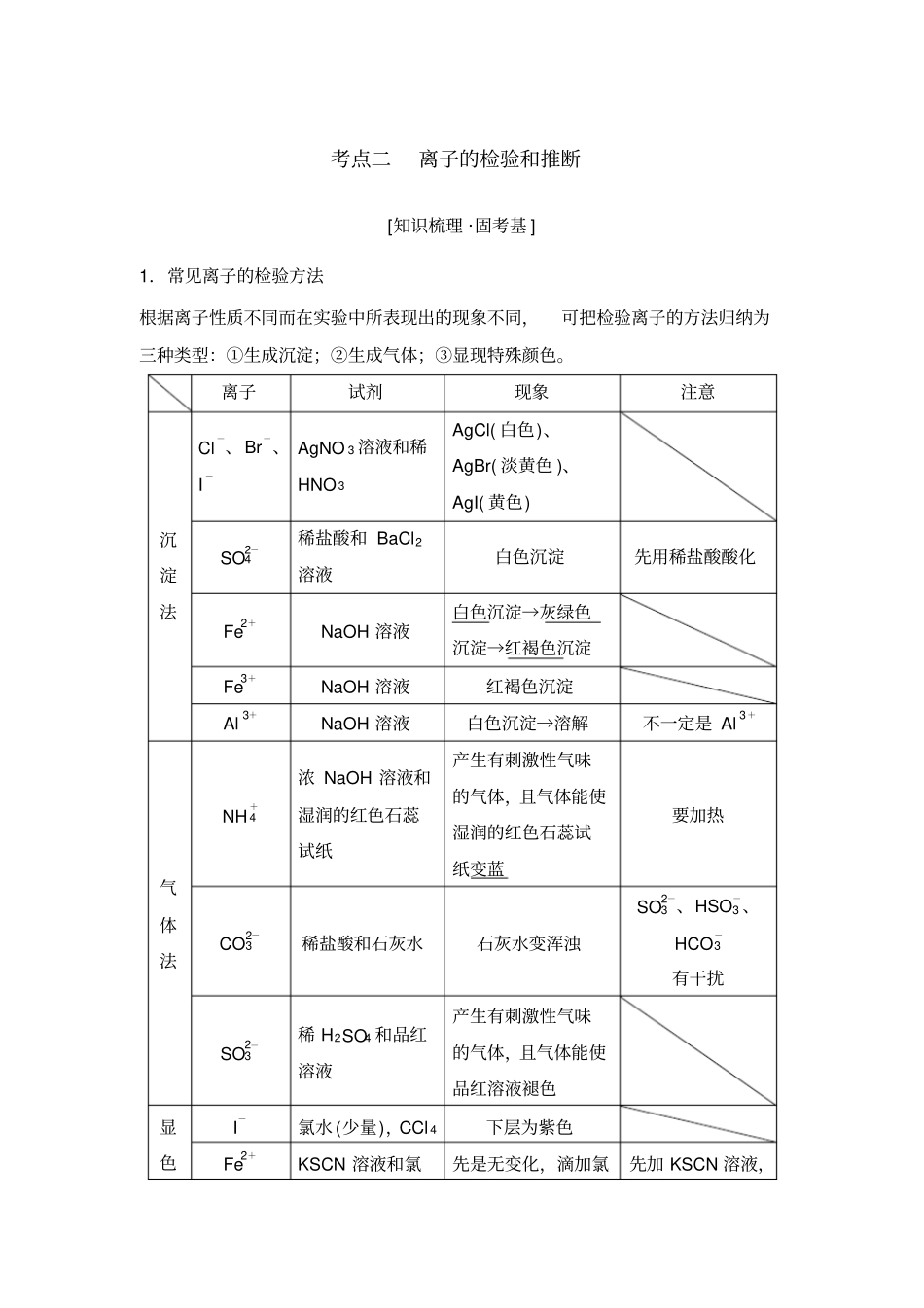
考点二离子的检验和推断[知识梳理 ·固考基 ] 1.常见离子的检验方法根据离子性质不同而在实验中所表现出的现象不同,可把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。离子试剂现象注意沉淀法Cl-、Br-、I-AgNO 3 溶液和稀HNO 3AgCl( 白色)、AgBr( 淡黄色 )、AgI( 黄色) SO2-4稀盐酸和 BaCl2溶液白色沉淀先用稀盐酸酸化Fe2+NaOH 溶液白色沉淀→灰绿色沉淀→红褐色沉淀Fe3+NaOH 溶液红褐色沉淀Al3+NaOH 溶液白色沉淀→溶解不一定是 Al3+气体法NH+4浓 NaOH 溶液和湿润的红色石蕊试纸产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝要加热CO2-3稀盐酸和石灰水石灰水变浑浊SO2-3 、HSO-3 、HCO-3有干扰SO2-3稀 H2SO4 和品红溶液产生有刺激性气味的气体,且气体能使品红溶液褪色显色I-氯水 (少量),CCl 4下层为紫色Fe2+KSCN 溶液和氯先是无变化,滴加氯先加 KSCN 溶液,法水水后变血红色无变化,再加氯水Fe3+KSCN 溶液血红色苯酚溶液紫色Na+、K+Pt(Fe)丝和稀盐酸火焰分别呈黄色、紫色K+要透过蓝色钴玻璃片观察焰色2.破解离子推断的 “四项原则 ”(1)肯定性原则:根据实验现象推出溶液中肯定存在或肯定不存在的离子;(记住几种常见的有色离子: Fe2+、Fe3+、Cu2+、MnO-4、CrO2-4 、Cr2O2-7 ) (2)互斥性原则:在肯定某些离子的同时,结合离子共存规律,否定一些离子的存在; (要注意题目中的隐含条件,如:酸性、碱性、指示剂的变化、与铝反应产生 H2、水的电离情况等 ) (3)电中性原则:溶液呈电中性,一定既有阳离子,又有阴离子,且溶液中正电荷总数与负电荷总数相等;(这一原则可帮助我们确定一些隐含的离子) (4)进出性原则:通常是在实验过程中使用,是指在实验过程中反应生成的离子或引入的离子对后续实验的干扰。提醒:解答与离子反应有关的定量推断类试题,需要掌握定量推断最后一种离子存在的方法: 如果多种离子共存, 且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在, 即阳离子所带正电荷总数等于阴离子所带负电荷总数。1.(LK 必修 1·P475 改编 )化学实验过程往往会产生污水,请用实验的方法检验污水中的下列重金属离子,并写出相应的离子方程式。Cu2+检验:取少许污水于试管中,加入NaOH 溶液若有蓝色沉淀,说明有Cu2+离子方程式: Cu2++2OH-===Cu(OH)2↓Ba2+检验:取少量污水于试管中,...