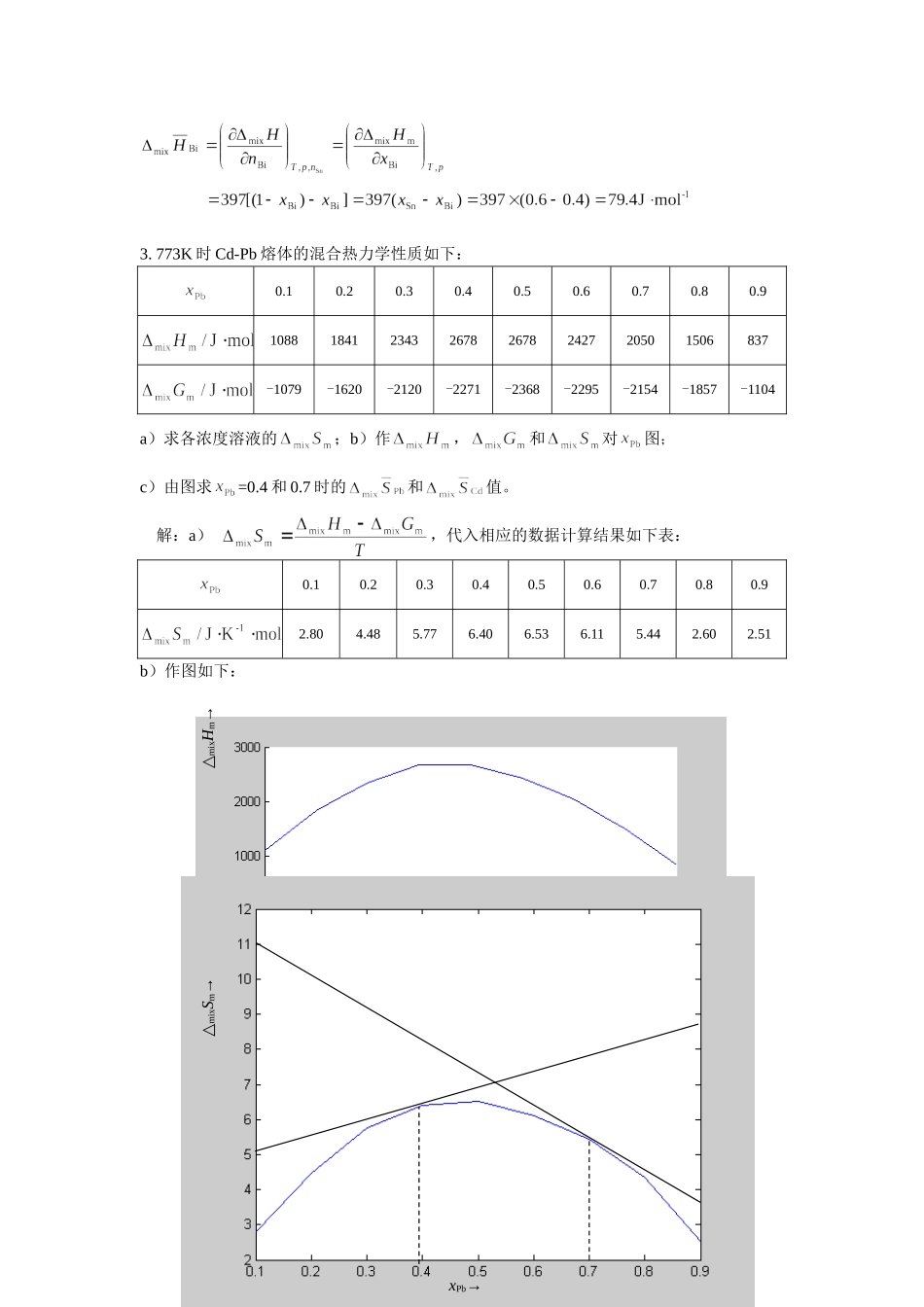
冶金热力学(Ⅱ)习题(第1章)1.在1873K将1mol固体Cr加入到xFe=0.8的大量Fe-Cr熔体中,若熔体为理想溶液,试计算因Cr的加入引起的焓和熵的变化。设Cr的固体与液体热容之差可以忽略,已知Cr的熔点为2173K,熔化热为21000J·mol-1。解:因为是将1mol固体Cr加入到xFe=0.8的大量Fe-Cr熔体中,因此,加入1mol固体Cr后熔体的组成可视为不变。则熔化过程可用以下循环表示:因为形成理想溶液,所以因Cr的加入引起的焓变应该为:故且又Cr的固体与液体热容之差可以忽略,则△H1=-△H3,△S1=-△S3,2.在603K液体Sn-Bi合金的全摩尔混合热可表示为,试导出和与组成的关系式,并计算当xBi=0.4时的和的值。解:则由已知条件得:,故:Cr(s,1873K)Cr(linFe,1873K)Cr(s,2173K)Cr(l,2173K)Cr(l,1873K)△H,△S△H1△S1△mixHm△mixSm△H2△S2△H3△S33.773K时Cd-Pb熔体的混合热力学性质如下:0.10.20.30.40.50.60.70.80.910881841234326782678242720501506837-1079-1620-2120-2271-2368-2295-2154-1857-1104a)求各浓度溶液的;b)作,和对图;c)由图求=0.4和0.7时的和值。解:a),代入相应的数据计算结果如下表:0.10.20.30.40.50.60.70.80.92.804.485.776.406.536.115.442.602.51b)作图如下:△mixHm→←△mixGmxPb→△mixSm→xPb→c)在~图中的=0.4和0.7处作切线,在两个纵坐标的截距就分别是和值,=0.4时=8.65J·K-1·mol-1,=4.92J·K-1·mol-1;=0.7时=2.72J·K-1·mol-1,=11.71J·K-1·mol-1。4.1500K时Au-Cu熔体的与组成的关系为:0.10.20.30.40.50.60.70.80.9-2170-3850-5050-5770-6010-5770-5050-3850-2190试计算:(a)时溶液的、和;(b)时1500K溶液Au和Cu的平衡分压。已知液体纯金属的饱和蒸气压(Pa):(1336—Tb)(1336—Tb)解:(a)依题目所给数据作曲线如下图,在曲线处做切线可得切线斜率因此,(b)1550K下,5.可逆电池Cd(纯)|LiCl-KCl-CdCl2(熔体)|Cd(Cd-Sb合金)在773K,Cd-Sb合金中时,实验测得电动势E=0.02848V,电动势温度系数,试计算以纯镉为参考态时合金中镉的、和。解:题给电池为浓差电池Cd(纯)====Cd(aCd),其电动势而,所以,当xCd=0.602,T=773K时(1)(2)(3)(4)6.Mg-Zn合金中锌的活度系数表示式:试计算1000K,xMg=0.32时,Mg-Zn合金中镁的活度系数和活度。解: ∴故1000K,xMg=0.32时,,7.1423K时液体Ag-Cu合金的过剩热力学性质:,求和与组成的关系式,并计算xCu=0.5时Cu的活度。解:根据“斜截公式”有:,由题给条件得:故,所以,当xCu=0.5时,xAg=0.5,则,,故8.在1600℃与纯固体TiO2和H2O-H2混合气平衡的Fe-Ti熔体中以1wt.%Ti为参考态的活度,,求Ti在铁液中的。解:(1)Ti(s,纯)+H2O(g)====TiO(s)+2H2(g)(2)Ti(s,纯)+O2(g)====TiO(s)(3)H2(g)+0.5O2(g)====H2O(g)显然,(1)=(2)-2(3),所以,而:则9.固体纯钒为参考态转换为Fe液中1wt%为参考态的自由能变化为:试计算1600℃时Fe液中的;如果液体Fe-V溶液与固体纯VO和的气相平衡,试计算在选择不同参考态时V在Fe液中的活度:a)以纯固体V为参考态;b)以纯液体V为参考态;c)以亨利定律为基准纯固体V为参考态;d)以Fe液中1wt%V为参考态。解:查表得V的熔化温度为1730℃,熔化热,则:故V(aV)+0.5O2(g)====VO(s)a)以纯固体V为参考态:V(s,纯)+0.5O2(g)→VO(s)此时故b)以纯液体V为参考态:V(s,纯)→V(l,纯)V(s,纯)+0.5O2(g)→VO(s)V(l,纯)+0.5O2(g)→VO(s)故c)以亨利定律为基准纯V为参考态:V(l,纯)→V(l,x)V(l,纯)+0.5O2(g)→VO(s)V(l,x)+0.5O2(g)→VO(s)故d)以Fe液中1wt%V为参考态: ∴10.溶解有氧和铝的铁液盛于Al2O3坩埚中,在1600℃和下处于平衡。若欲使铁尖晶石(FeO·Al2O3)与铁液和固体Al2O3出现平衡,必须达到何值?在上述平衡出现时,以1wt%Al为参考态铁液中Al的活度为多少?在1600℃,该平衡的自由度为多少?已知:0.5O2(g)====O(1wt%,铁液中)Al(l)====Al(1wt%,铁液中)FeO·Al2O3(s)====Fe(l)+O(1wt%,铁液中)+Al2O3(s)解:由FeO·Al2O3(s)====Fe(l)+O(1wt%,铁液中)+Al2O3(s)①和0.5O2(g)====O(1wt%,铁液中)②得题目...