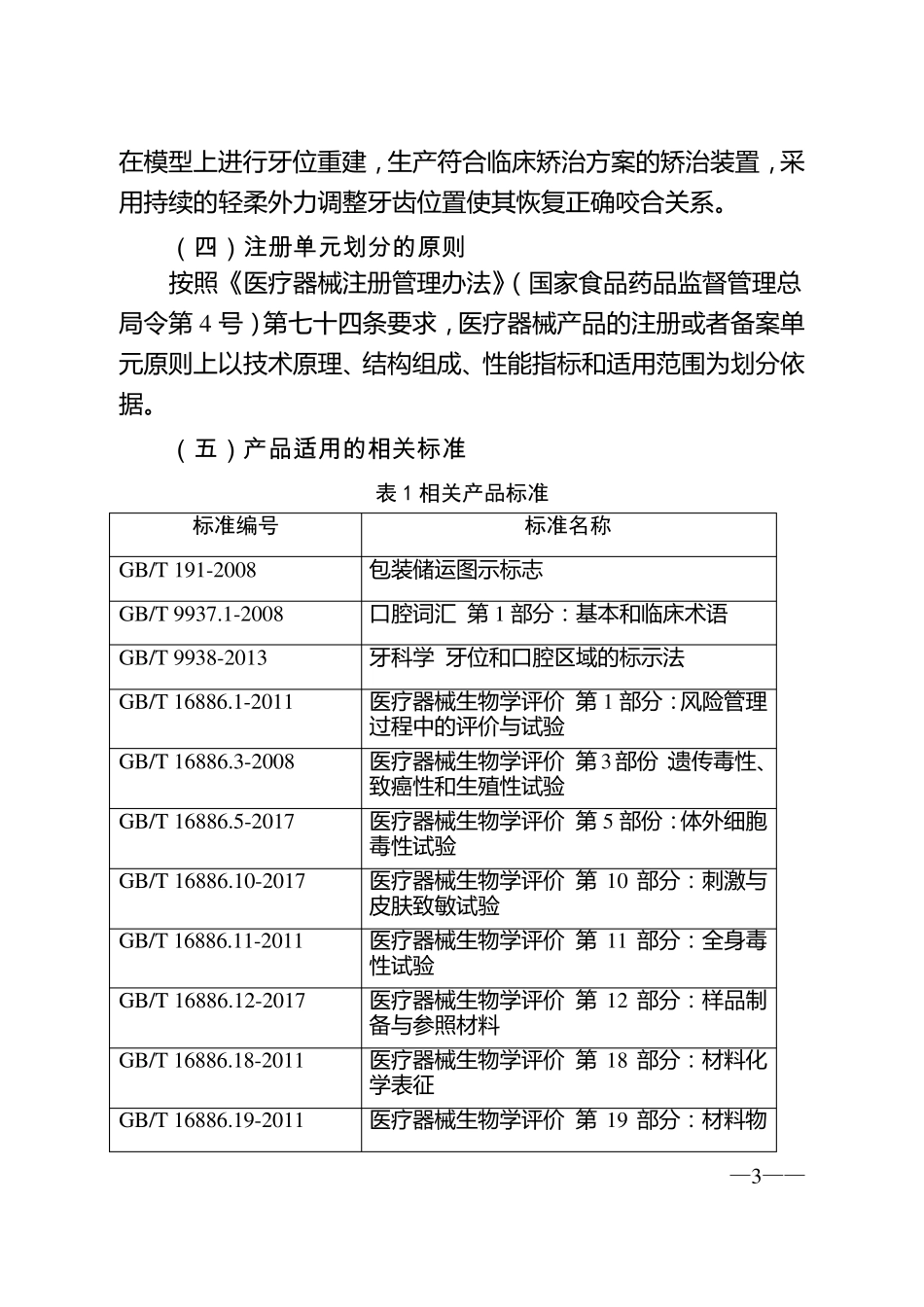
—1 — 广 东省定制式矫治器产品 注册技术审查指导原则 本指导原则旨在指导注册申请人对定制式矫治器注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。 本指导原则是对定制式矫治器的通用要求,申请人应依据产品的具体特性确定其中内容,若不适用,需具体阐述理由及提供相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。 本指导原则是供申请人和审查人员使用的指导文件,不作强制执行,若有能够证明产品安全有效的其他方法,也可以采用,但应提供详细的研究资料和验证资料,在遵循相关法规的前提下使用本指导原则。 本指导原则是根据现行法规、标准及当前认知水平下结合广东省 矫治器类 产品生 产实际 情 况 制定,当法规、标准进行调 整 和认知水平发 生 变 化时,本指导原则相关内容也将 同步 进行调 整 。 一、适用范围 本指导原则的适用范 围 为无 托 槽 结构 的活 动 矫治器,是根据临 床 矫治方案 设 计 由牙 胶 片 或 牙 科膜 片 等 适宜 的热 塑 性高 分 子材 料制成 可自 行摘 戴 的一 系 列 矫治装 置 。参考 2 0 1 7 年 8 月 3 1 日发 布 的《 医 疗 器械 分 类 目 录 》 ( 国 家 食 品药 品监 督 管 理总 局 公 告2 0 1 7 年 第1 0 4 号 ) ,新 的分 类 编 码 为 1 7 -0 7 -0 7 ,管 理类 别 为Ⅱ类 。 本指导原则不适用于由带环、托 槽 和弓丝等 组成 的固定矫治—2 —— 器 , 由 固 位 装 置 、作用力部分和基托等组成的活动矫治器 , 也不适用于由 未取得医疗器 械注册证的牙胶片或牙科膜片制成的矫治器 及具有标准尺寸的非定制式矫治保持器 、运动牙套和止鼾器等。 二、技术审查要点 ( 一)产品名称 产品命名应符合《医疗器 械通用名称命名规则》(国家食品药品监督管理总局令第 1 9 号)和国家标准、行业标准中的通用名称要求, 如:定制式矫治器 、定制式无托槽矫治器 。 ( 二)产品的结构和组成 产品由 经食品药品监督管理部门批准注册的牙科膜片/牙胶片压制而成, 不包含附件及相关软件。产品示意图见下图。 图 1 定制式矫治器 ( 三)产品工作原理 生产企业依据临床机构提供的矫治方案和/或患者的口腔模型,—3—— 在 模 型 上 进 行 牙 位 重 建 , 生 产 符 合 临 床 矫...