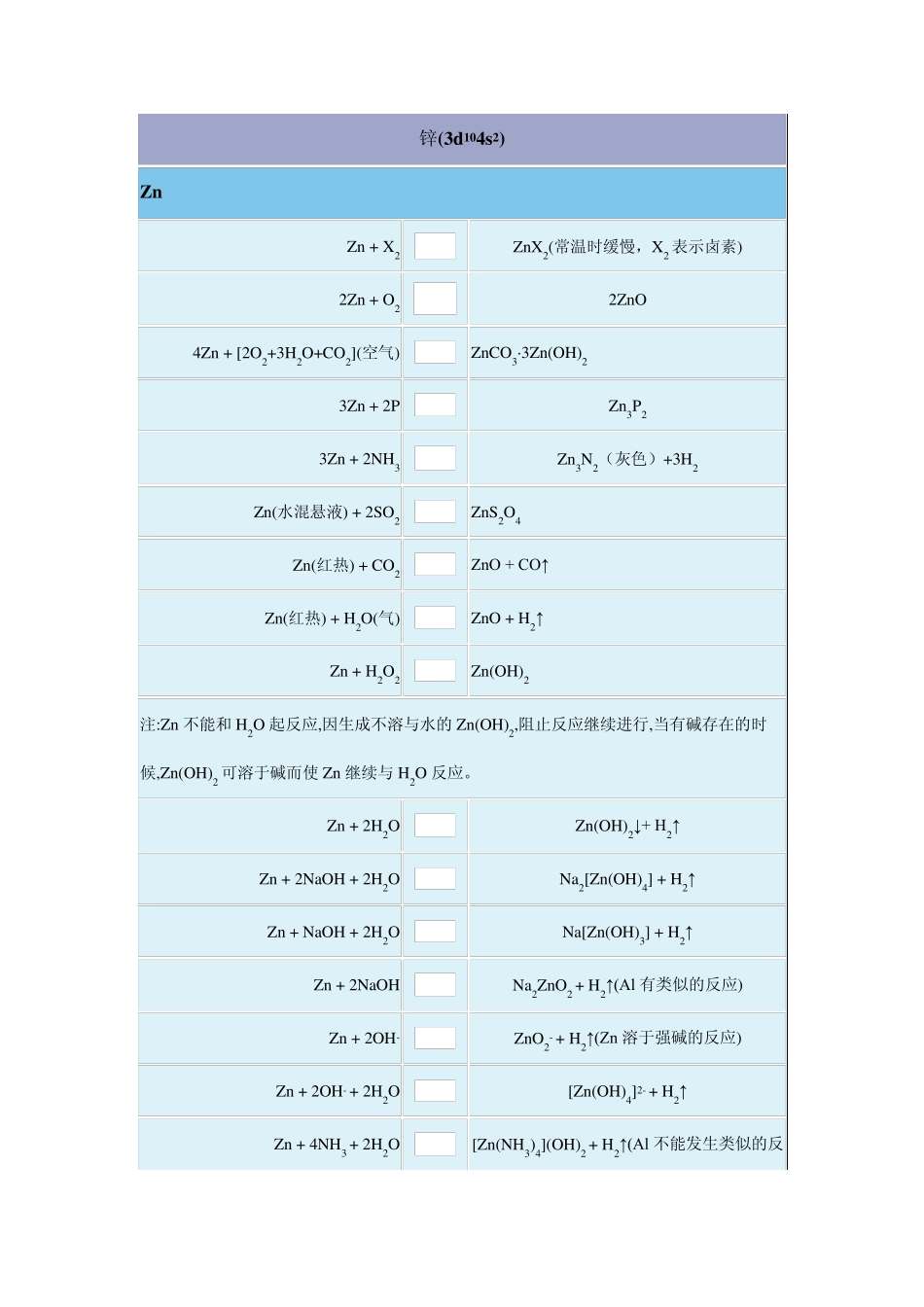
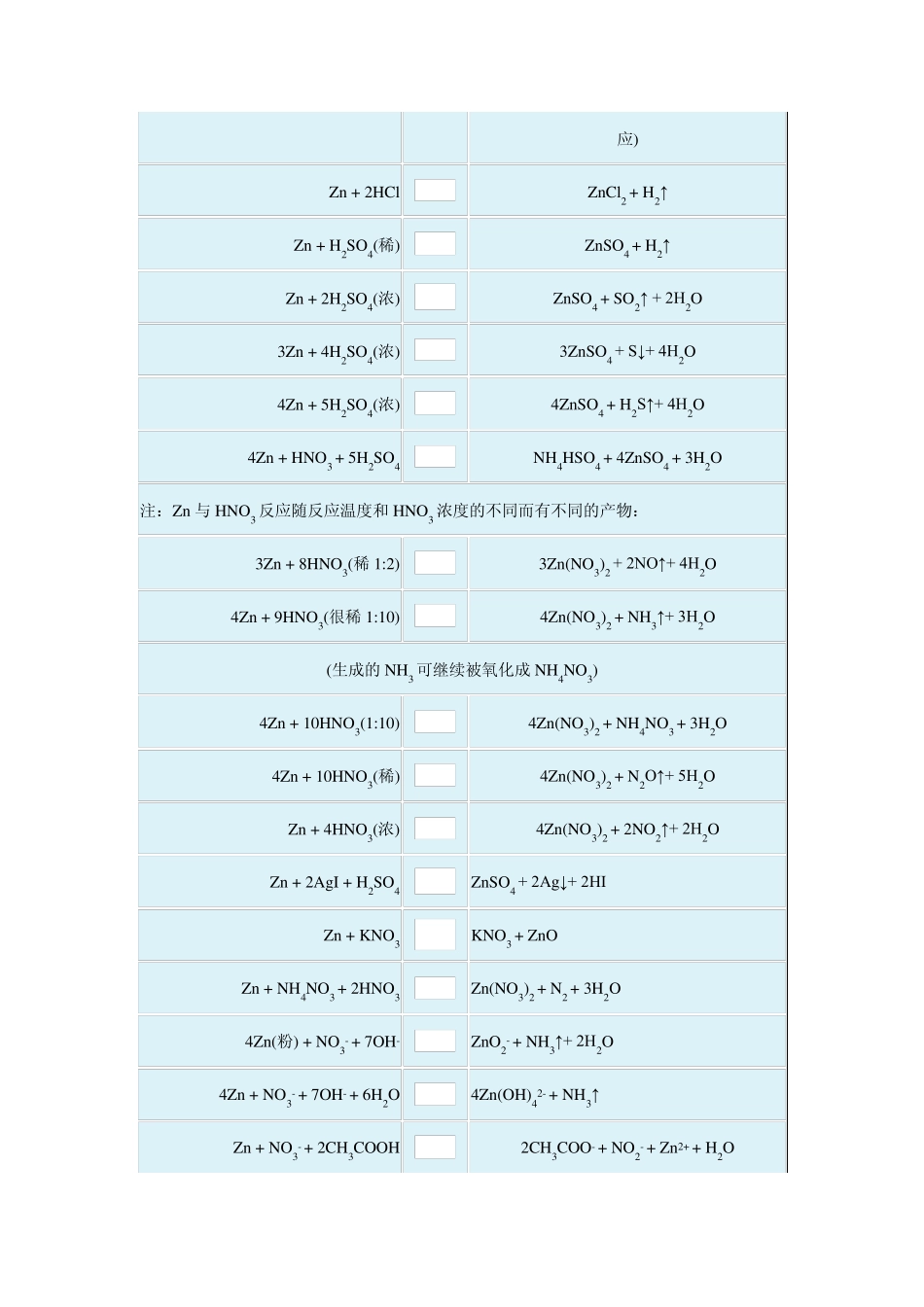
锌(3d104s2) Zn Zn + X2 ZnX2(常温时缓慢,X2 表示卤素) 2Zn + O2 2ZnO 4Zn + [2O2+3H2O+CO2](空气) ZnCO3·3Zn(OH)2 3Zn + 2P Zn3P2 3Zn + 2NH3 Zn3N2(灰色)+3H2 Zn(水混悬液) + 2SO2 ZnS2O4 Zn(红热) + CO2 ZnO + CO↑ Zn(红热) + H2O(气) ZnO + H2↑ Zn + H2O2 Zn(OH)2 注:Zn 不能和H2O 起反应,因生成不溶与水的Zn(OH)2,阻止反应继续进行,当有碱存在的时候,Zn(OH)2 可溶于碱而使Zn 继续与H2O 反应。 Zn + 2H2O Zn(OH)2↓+ H2↑ Zn + 2NaOH + 2H2O Na2[Zn(OH)4] + H2↑ Zn + NaOH + 2H2O Na[Zn(OH)3] + H2↑ Zn + 2NaOH Na2ZnO2 + H2↑(Al 有类似的反应) Zn + 2OH- ZnO2- + H2↑(Zn 溶于强碱的反应) Zn + 2OH- + 2H2O [Zn(OH)4]2- + H2↑ Zn + 4NH3 + 2H2O [Zn(NH3)4](OH)2 + H2↑(Al 不能发生类似的反应) Zn + 2HCl Zn Cl2 + H2↑ Zn + H2SO4(稀) Zn SO4 + H2↑ Zn + 2H2SO4(浓) Zn SO4 + SO2↑ + 2H2O 3Zn + 4H2SO4(浓) 3Zn SO4 + S↓+ 4H2O 4Zn + 5H2SO4(浓) 4Zn SO4 + H2S↑+ 4H2O 4Zn + HNO3 + 5H2SO4 NH4HSO4 + 4Zn SO4 + 3H2O 注:Zn 与HNO3 反应随反应温度和HNO3 浓度的不同而有不同的产物: 3Zn + 8HNO3(稀1:2) 3Zn (NO3)2 + 2NO↑+ 4H2O 4Zn + 9HNO3(很稀1:10) 4Zn (NO3)2 + NH3↑+ 3H2O (生成的NH3 可继续被氧化成 NH4NO3) 4Zn + 10HNO3(1:10) 4Zn (NO3)2 + NH4NO3 + 3H2O 4Zn + 10HNO3(稀) 4Zn (NO3)2 + N2O↑+ 5H2O Zn + 4HNO3(浓) 4Zn (NO3)2 + 2NO2↑+ 2H2O Zn + 2AgI + H2SO4 Zn SO4 + 2Ag↓+ 2HI Zn + KNO3 KNO3 + Zn O Zn + NH4NO3 + 2HNO3 Zn (NO3)2 + N2 + 3H2O 4Zn (粉) + NO3- + 7OH- Zn O2- + NH3↑+ 2H2O 4Zn + NO3- + 7OH- + 6H2O 4Zn (OH)42- + NH3↑ Zn + NO3- + 2CH3COOH 2CH3COO- + NO2- + Zn 2+ + H2O 5Zn + 2MnO4- + 16H+ 2Mn2+ + 5Zn2+ + 8H2O 注:干电池使用时的电极反应: 锌极:Zn Zn2+ + 2e- 碳极:2NH4+ + 2e- 2NH3 + H2 H2 + MnO2 MnO + H2O 电极总反应:2NH4+ + MnO2 + 2e- MnO + 2NH3 + H2O 净电池反应:Zn + 2MnO2 + 2NH4Cl(液) 2MnO(OH)(s) + [Zn(NH3)2]Cl2(l) 注:银...