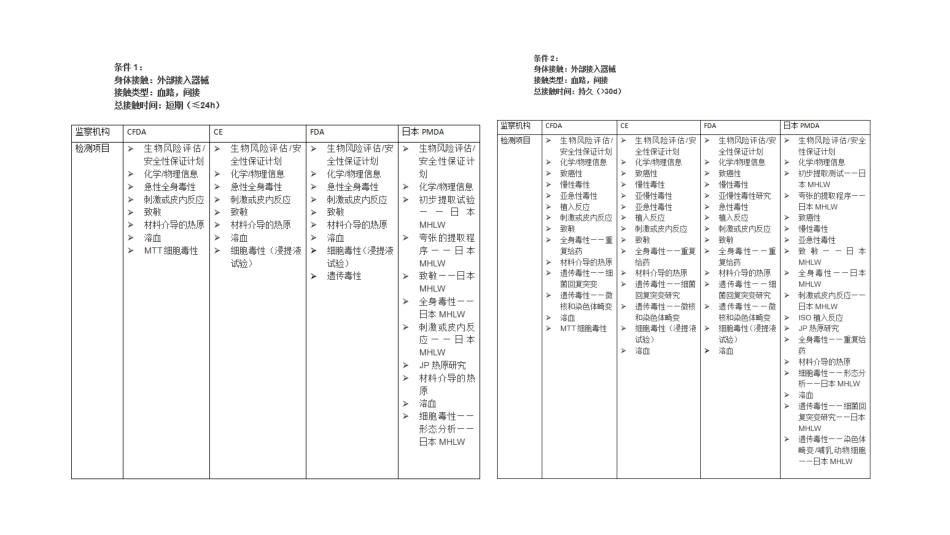
Loremipsumdolorsitamet,consecteturadipisicingelit.医疗器械行业产品分类及检测项目介绍一、医疗器械分类Loremipsumdolorsitamet,consecteturadipisicingelit.二、检测项目分布情况Loremipsumdolorsitamet,consecteturadipisicingelit.三、医疗器械试验项目Loremipsumdolorsitamet,consecteturadipisicingelit.一、概述为确保无菌医疗器械的质量以及临床医疗使用的安全、有效,在生产过程管理中对于原料选择、配方、工艺流程、直至最终成品,常需要选择一些检测项目进行筛检,用于生产工艺过程的监控以及最终产品放行的把关检验。ISO10993-1(GB/T16886.1)标准4.1条明确指出,预期用于人体的任何材料或器械的选择与评价需遵循YY/T0316开展的风险管理过程中生物学评价程序。生物学评价应有掌握理论知识和具有经验的专业人员来策划、实施并形成文件。在选择制造器械所用材料时,应首先考虑材料的特点和性能,包括化学、毒理学、物理学、电学、形态学和力学等性能。检测项目1、物理检测——2、化学检测如pH值、重金属、还原物质、重金属、氯化物蒸发残渣等。3、生物相容性检测体外的细胞毒性试验和溶血试验,应作为首选筛检试验项目。二、检测项目三、生物相容性评价医疗器械因为直接应用于人体,有否毒性是人们最关注的问题。国际标准化组织(ISO)在发布的《ISO10993医疗器械生物学评价第一部分:风险管理过程中的评价与试验》引言中明确指出:“本部分的作用是为策划医疗器械生物学评价提供框架,即随着科学进步和对组织反应机理的掌握,在能获得与体内模型同等相应信息的情况下,应优先采用化学分析试验和体外模型,以便试验动物的使用数量为最小”。三、生物相容性评价生物相容性评价可按医疗器械接触人体部位(皮肤、粘膜、组织、血液等)、接触方式(直接、间接或植入)、接触时间(短时、长期和持久)和用途分类。生物相容性评价接触人体部位接触方式接触时间按用途分类皮肤、粘膜、组织、血液等直接、间接或植入短时、长期和持久其它三、生物相容性评价1、细胞毒性试验本法是将细胞和材料直接接触,或将材料浸出液加到单层培养的细胞上,观察器械、材料和/或其浸提液引起的细胞溶解、细胞生长抑制等毒性影响作用。常用L-929细胞株。2、刺激与迟发性超敏反应试验本部分用于评价从医疗器械中释放出的化学物质可能引起的接触性危害,包括导致皮肤与粘膜刺激、口、眼刺激和迟发型接触超敏反应。动物常用兔、豚鼠、金地鼠。3、全身毒性试验用材料或其浸提液,通过单一途径或多种途径(静脉、腹腔)用动物模型做试验。动物常用小白鼠。三、生物相容性评价4、亚慢性毒性(亚急性毒性)通过多种途径,在不到试验动物寿命10%的时间内(例如大鼠最多到90天),测定材料的有害作用。动物常用兔、大白鼠。5、遗传毒性(包括细菌性基因突变试验、哺乳动物基因畸变试验和哺乳动物基因突变试验)用哺乳动物或非哺乳动物细胞、细菌、酵母菌或真菌测定材料、器械或浸提液是否引起基因突变、染色体结构畸变以及其他DNA或基因变化的试验。6、植入将材料植入动物的合适部位(例如肌肉或骨),观察一个周期后,评价对活组织的局部毒性作用。动物常用兔、大白鼠。三、生物相容性评价7、血液相容性血液相容性是通过材料与血液接触(体内或半体内),评价其对血栓形成、血浆蛋白、血液有形成分和补体系统的作用。8、慢性毒性通过多种途径,在不少于试验动物大部分寿命期内(例如大鼠通常在6个月),一次或多次接触医疗器械、材料和/或其浸提液的作用。动物常用大白鼠。9、致癌牲由单一途径或多种途径,在试验动物整个寿命期(例如大鼠为二年),测定医疗器械潜在的致癌作用。三、生物相容性评价10、生殖与发育毒性评价医疗器械或其浸提液对生殖功能、胚胎发育(致畸性)、以及对胎儿和婴儿早期发育的潜在作用。11、生物降解针对可能产生降解产物的医用材料,如聚合物、陶瓷、金属和合金等,判定潜在降解产物的试验。12、毒代动力学研究采用生理药代动力学模型来评价某种巳知具有毒性或其毒性是未知的化学物的吸收、分布、代谢和排泄的试验。参见GB/T16886.16标准方法。13、免疫毒性GB/T16886.20给出了免疫...