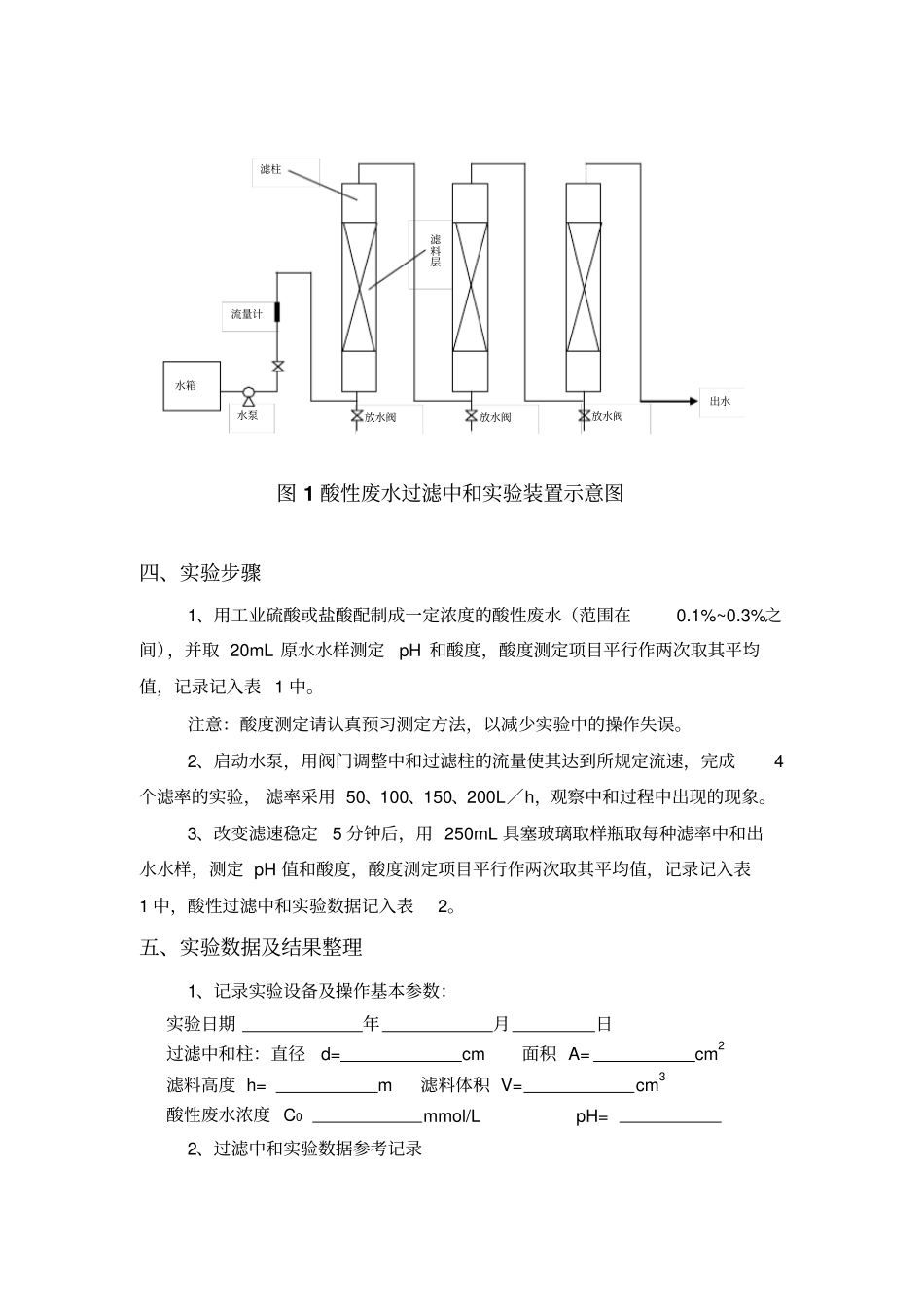
实验八 酸性废水中和实验一、实验目的通常把含酸量在 3%~5%以上的高浓度含酸废水称为废酸液,对于废酸液,应考虑回收利用的可能性, 如用扩散渗透法回收钢铁酸性废液中的硫酸。当酸浓度不高(低于 3%)时,回收利用意义不大,可采用中和法处理。目前常用的中和方法有酸碱废水中和、药剂中和及过滤中和三种。过滤中和法具有设备简单、造价便宜、不需投加药剂、耐冲击负荷等优点,故再生产中应用很多。由于过滤中和时,废水在滤池中的停留时间、滤率与废水中酸的种类、浓度等有关,常常需要通过实验来确定滤率、 滤料消耗量等参数, 以便为工艺设计和运行管理提供依据。通过实验希望达到以下目的:1、了解滤率与酸性废水浓度、出水pH 之间的关系。2、掌握酸性废水过滤中和处理的原理与工艺。二、实验原理酸性废水流过碱性滤料时与滤料进行中和反应的方法称为过滤中和法。过滤中和法与投药中和法相比, 具有操作方便、 运行费用低、 劳动条件好及产生沉渣少(是废水量的0.5%)等优点,但不适于中和高浓度酸性废水。工厂排放的酸性废水可分为三类:1、含有强酸(如 HCl、HNO 3),其钙盐易溶解于水;2、含有强酸(如 H2SO4),其钙盐难溶解于水;3、含有弱酸(如 CO2、CH3COOH)碱性滤料主要有石灰石、白云石和大理石等。其中石灰石和大理石的主要成分时 CaCO3,而白云石的主要成分时CaCO3?MgCO 3。石灰石的来源较广,价格便宜,因而是最常用的碱性滤料。中和的 1 类酸性废水,各种滤料均可采用,反应后生成易溶于水的盐类而不沉淀。但废水中酸的浓度不能过高, 否则滤料消耗快, 给处理造成一定的困难,其极限浓度为 20g/L。中和第 2 类酸性废水时,如采用石灰石滤料,因反应后生成的钙盐难溶于水, 会附着在滤料表面, 阻碍滤料和酸的接触, 减慢中和反应速率,因此极限浓度应根据实验确定,若无实验资料,可采用3g/L。如用白云石滤料,由于生成的MgSO4溶解度很大,产生的沉淀仅为石灰石的一半,因而废水中 H2SO4 浓度可采用 5g/L,但白云石反应速率较石灰石慢,这影响了他的应用。中和第 3 类酸性废水时,弱酸与碳酸盐反应速率很慢,滤速应适当减小。 当酸性废水浓度较大或滤率较大时, 过滤中和后出水含有大量CO2 使出水 pH 声值偏低( pH=5 左右)。此时,可用吹脱法去除CO2 以提高 PH 值。当采用石灰石为滤料时,其中和反应方程式如下:2HCl+CaCO3CaCl2+H2O+CO22HNO3+CaCO3Ca(NO3)2+H2O+CO2H2SO4+CaCO...