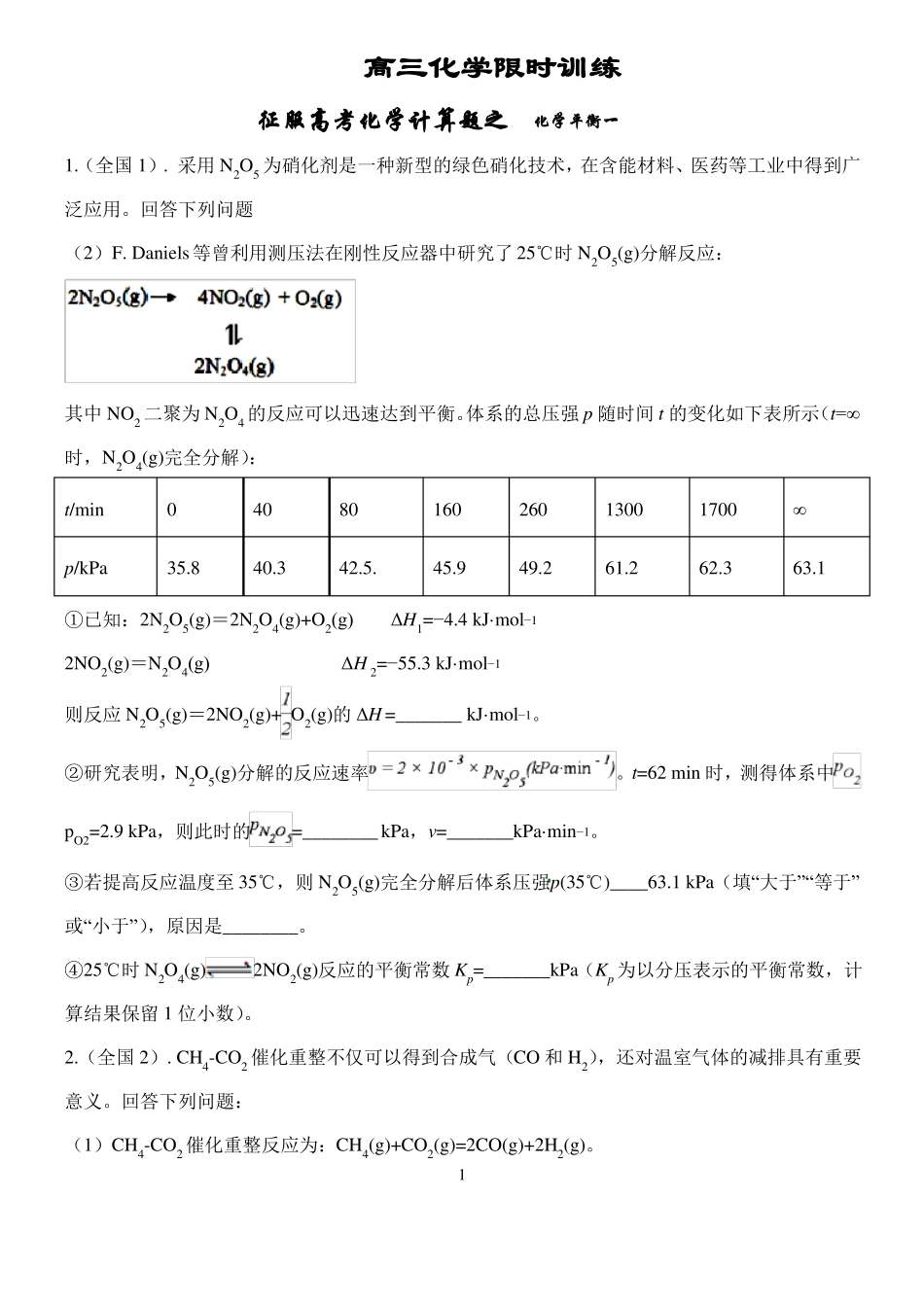
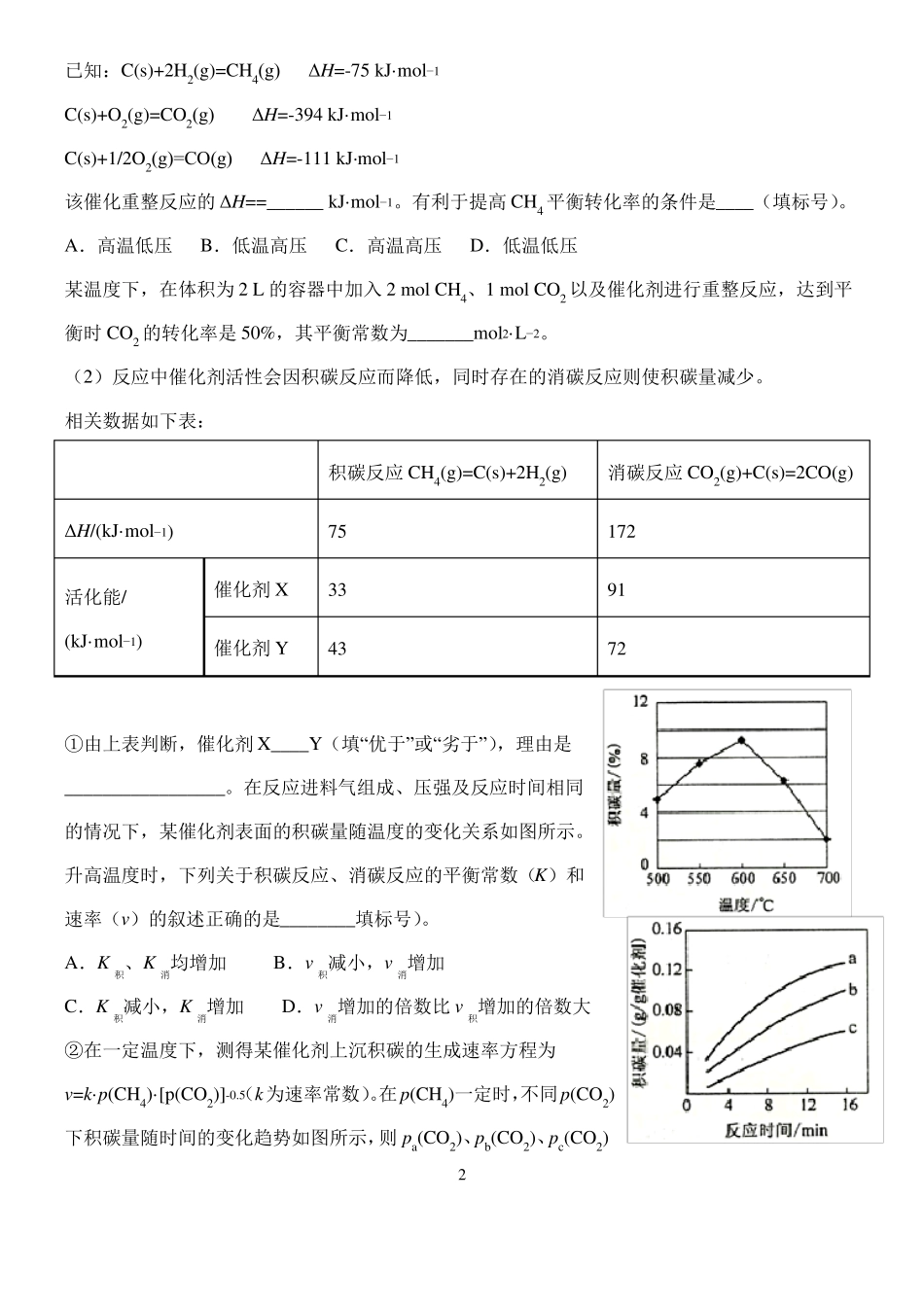
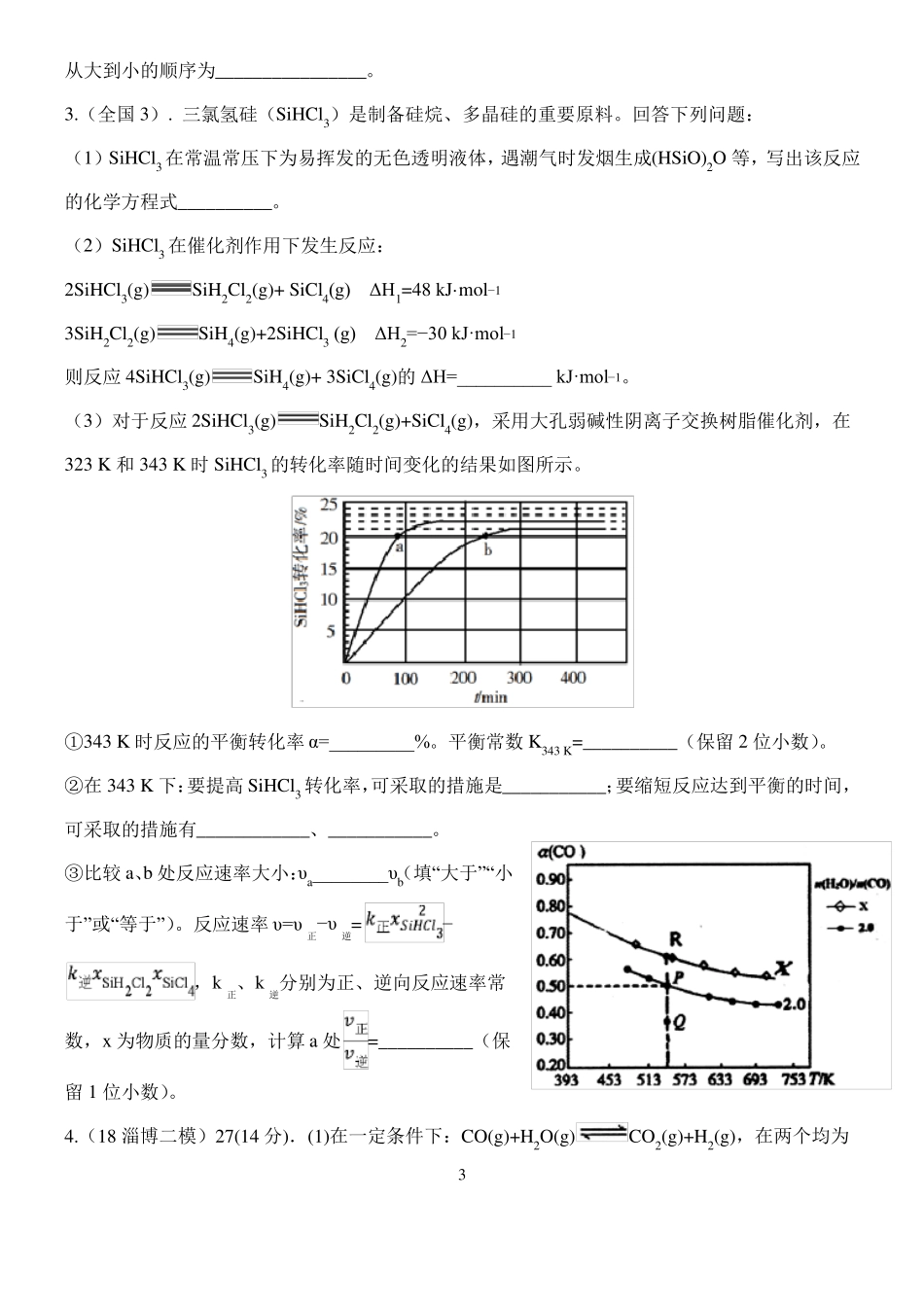
高三化学限时训练征服高考化学计算题之化学平衡一1.(全国 1). 采用 N2O5 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题(2)F. Daniels等曾利用测压法在刚性反应器中研究了 25℃时 N2O5(g)分解反应:其中 NO2 二聚为 N2O4 的反应可以迅速达到平衡。体系的总压强 p 随时间 t 的变化如下表所示(t=∞时,N2O4(g)完全分解):t/minp/kPa035.84040.38042.5.16045.926049.2130061.2170062.3∞63.1mol−1①已知:2N2O5(g)=2N2O4(g)+O2(g)ΔH1=−4.4 kJ·2NO2(g)=N2O4(g)ΔH 2=−55.3 kJ·mol−1mol−1。则反应 N2O5(g)=2NO2(g)+ O2(g)的 ΔH =_______ kJ·②研究表明,N2O5(g)分解的反应速率pO2=2.9 kPa,则此时的=________ kPa,v=_______kPa·min−1。。t=62 min 时,测得体系中③若提高反应温度至 35℃,则 N2O5(g)完全分解后体系压强p(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。④25℃时 N2O4(g)2NO2(g)反应的平衡常数 Kp=_______kPa(Kp 为以分压表示的平衡常数,计算结果保留 1 位小数)。2.(全国 2). CH4-CO2 催化重整不仅可以得到合成气(CO 和 H2),还对温室气体的减排具有重要意义。回答下列问题:(1)CH4-CO2 催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。1mol−1已知:C(s)+2H2(g)=CH4(g)ΔH=-75 kJ·C(s)+O2(g)=CO2(g)ΔH=-394 kJ·mol−1C(s)+1/2O2(g)=CO(g)ΔH=-111 kJ·mol−1mol−1。有利于提高 CH4 平衡转化率的条件是____(填标号)该催化重整反应的 ΔH==______ kJ·。A.高温低压B.低温高压C.高温高压D.低温低压某温度下,在体积为 2 L 的容器中加入 2 mol CH4、1 mol CO2 以及催化剂进行重整反应,达到平L−2。衡时 CO2 的转化率是 50%,其平衡常数为_______mol2·(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:ΔH/(kJ·mol−1)活化能/(kJ·mol−1)①由上表判断,催化剂 X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。A.K积、K消均增加B.v积减小,v消增加C.K积减小,K消增加D.v消增加的倍数比 v积增加的...