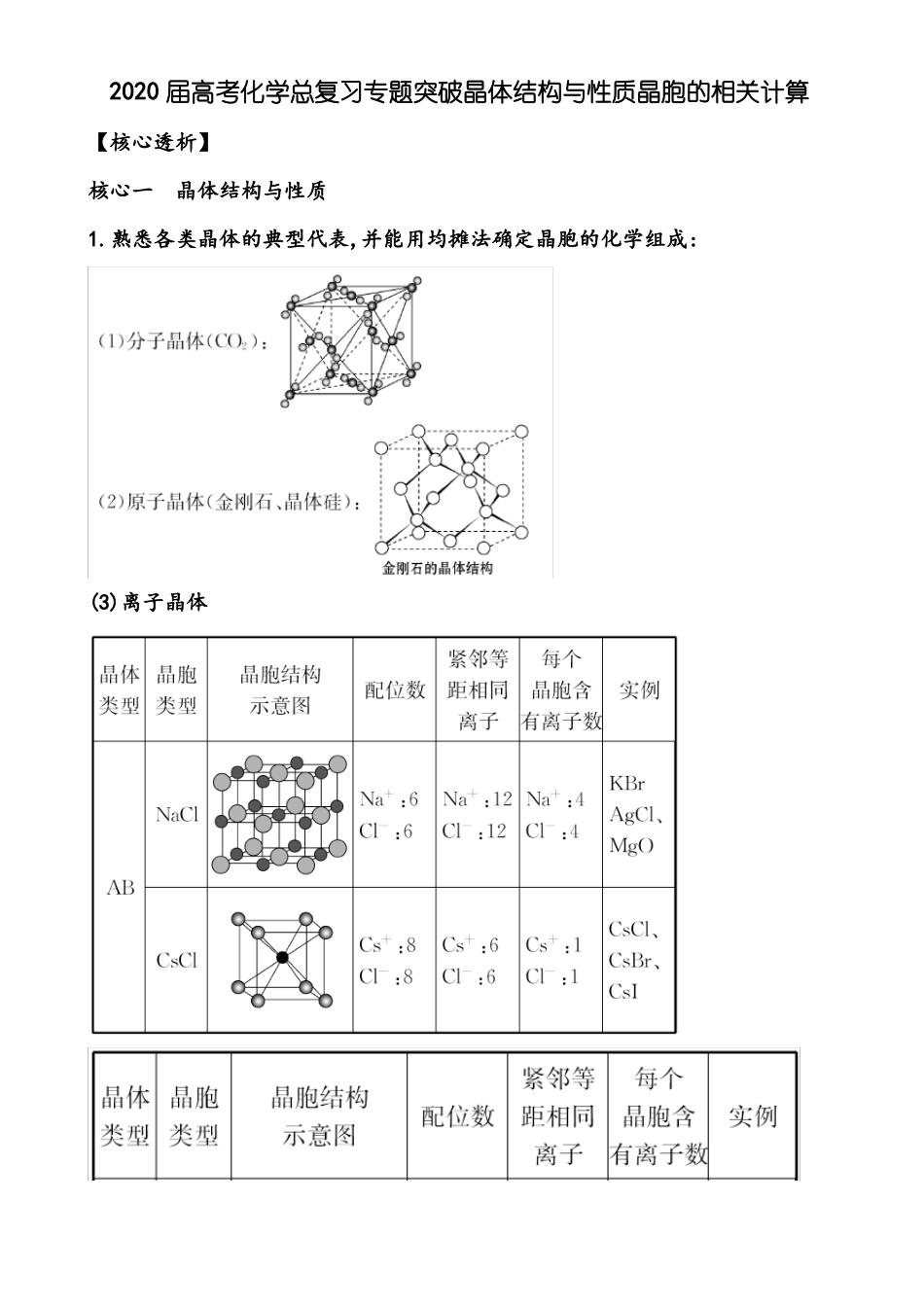
2020 届高考化学总复习专题突破晶体结构与性质晶胞的相关计算【核心透析】核心一晶体结构与性质1.熟悉各类晶体的典型代表,并能用均摊法确定晶胞的化学组成:(3)离子晶体(4)金属晶体2.晶体密度及微粒间距离的计算:若 1 个晶胞中含有 x 个微粒,则 1 mol 该晶胞中含有 x mol 微粒,其质量为 xM g(M为微粒的相对“分子”质量);1 个晶胞的质量为ρa3 g(a3为晶胞的体积),则 1 mol晶胞的质量为ρa3NA g,因此有 xM=ρa3NA。【答题技法】1.明确晶体类型的判断方法:(1)依据各类晶体的概念判断,即根据构成晶体的粒子和粒子间的作用力进行判断。如由分子通过分子间作用力(范德华力、氢键)形成的晶体属于分子晶体,由原子通过共价键形成的晶体属于原子晶体,由阴、阳离子通过离子键形成的晶体属于离子晶体,由金属阳离子和自由电子通过金属键形成的晶体属于金属晶体。(2)依据各类晶体的特征性质判断。如低熔沸点的晶体属于分子晶体 ;熔沸点较高、且在水溶液中或熔融状态下能导电的晶体属于离子晶体。熔沸点很高,不导电,不溶于水,硬度大的晶体属于原子晶体,能导热、导电,具有延展性的晶体属于金属晶体。2.突破晶体熔、沸点高低的比较:(1)一般情况下,不同类型晶体的熔沸点高低的比较规律 :原子晶体>离子晶体>分子晶体,如金刚石>NaCl>Cl2;金属晶体的熔、沸点差别很大,如金属钨、铂等熔点很高,汞、铯等熔点很低。(2)原子晶体由共价键形成的原子晶体中,原子半径越小,键长越短,键能越大,晶体的熔沸点越高。如熔点:金刚石>碳化硅>硅。(3)离子晶体一般来说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用力就越强,其晶体的熔、沸点就越高,如熔点:MgO>NaCl>CsCl。(4)分子晶体①组成和结构相似的分子晶体 ,相对分子质量越大,熔、沸点越高。如SnH4>GeH4>SiH4>CH4。②具有氢键的分子晶体熔、沸点反常得高。如 H2O>H2S。③组成和结构不相似的分子晶体(相对分子质量接近),分子极性越大,其熔、沸点越高。如 CO>N2,CH3OH>CH3CH3。④同分异构体分子中,支链越少,其熔沸点就越高,如正戊烷>异戊烷>新戊烷。(5)金属晶体金属阳离子半径越小,离子所带电荷数越多,金属键越强,金属熔沸点就越高。如熔沸点:Al>Mg>Na。【题型突破】题型 1微粒作用与晶体结构例 1.(1)图(a)为 S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因是______________________________________。2)K 和 Cr 属于同一周期,且核外最外层电子构型相同,但金属 K 的熔点、沸...