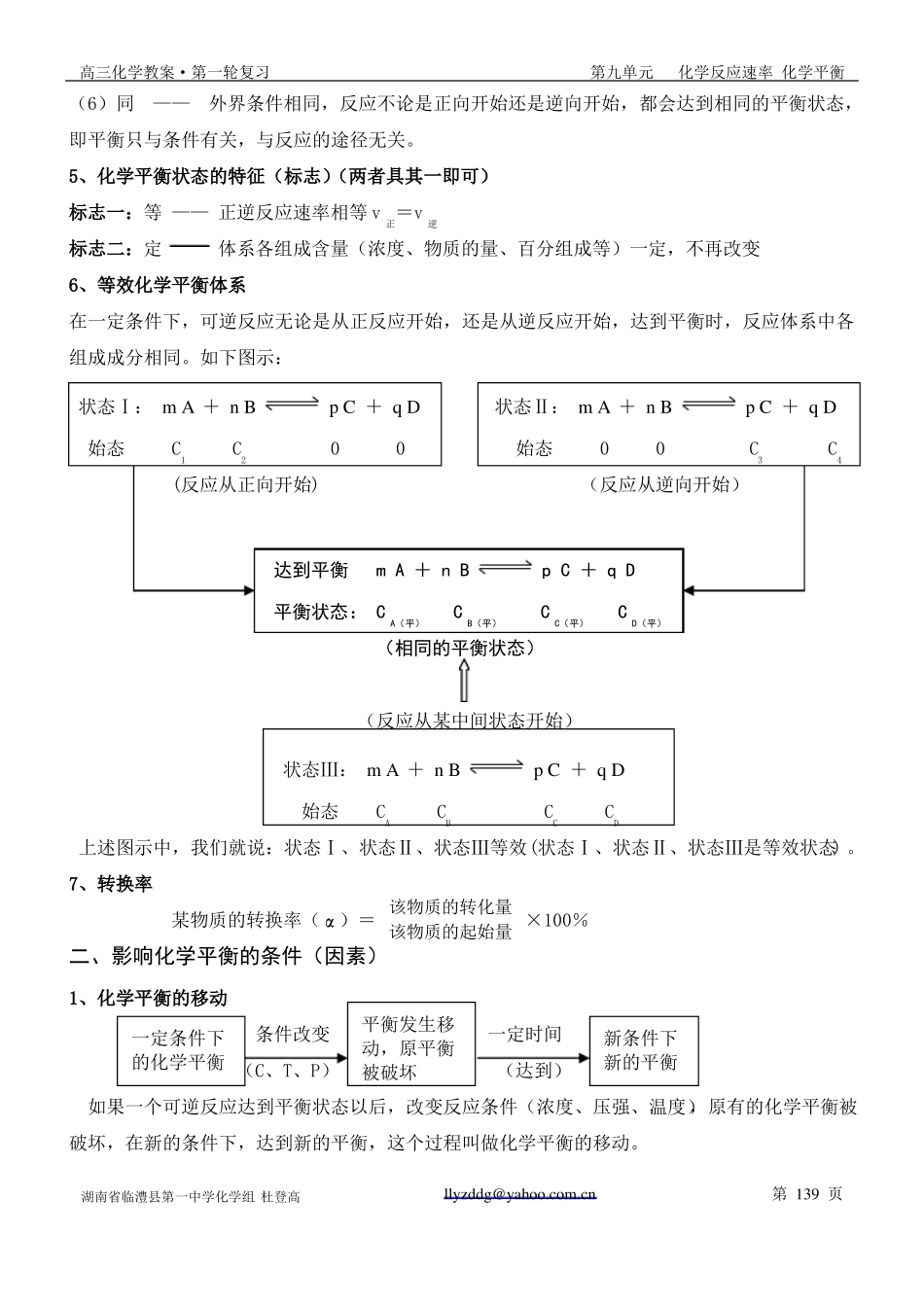
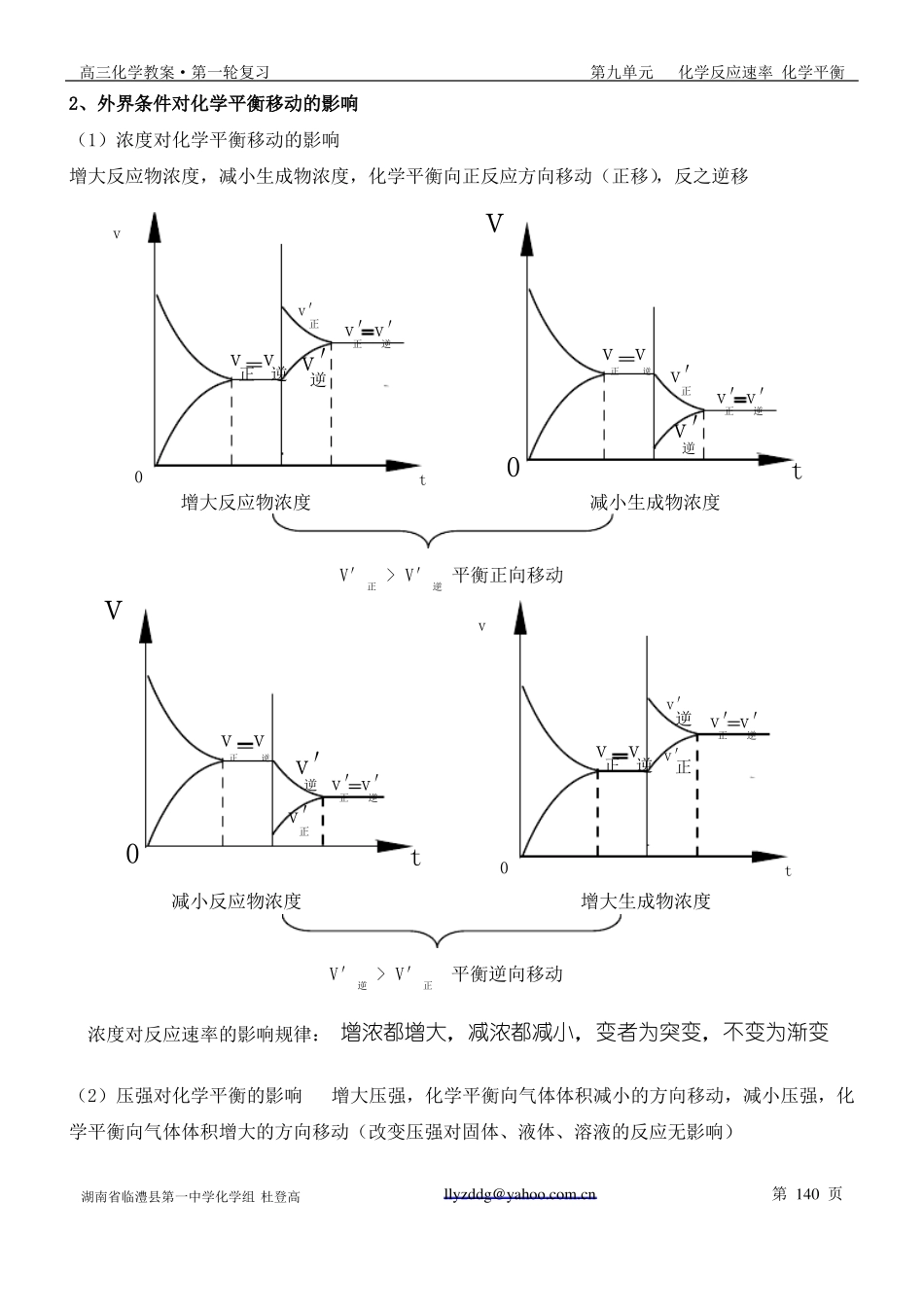
高三化学教案·第一轮复习第九单元化学反应速率 化学平衡§9-2化学平衡高考目标要求1、掌握化学平衡状态的建立及判断2、初步掌握化学平衡状态的有关计算3、了解化学平衡常数的意义及简单应用一、化学平衡是动态平衡1、化学平衡研究的内容:可逆反应的规律 ①反应进行的程度②外界条件对反应进行程度的影温馨提醒:可逆反应和互逆反应有区别,可逆反应是指在相同的条件下既能正向进行又能逆向进行的化学反应,如:N2(g) + 3H2(g) 2NH3(g) 可逆 ;互逆反应是指在不同反应条件下进行的点燃两个互为逆向的化学反应,如:H2 + O22、溶解平衡是动态平衡3、化学平衡状态的建立及化学平衡状态 2H2O 、 2H2O电解 2H2↑+ O2↑ 互逆。如果外界条件不发生变化,可逆反应进行到一定程度的时候,正反应和可逆反应的速率相等。反应物和生成物的含量(浓度、物质的量、百分组成等)不再发生变化(反应混合物中各物质的量一定)这时的状态就是化学平衡状态。vivv正iv正vv逆逆v正v逆v逆vtime正time(反应从逆向开始达到平衡)(反应从正向开始达到平衡)4、化学平衡的特点 :逆、等、动、定、变、同(1)逆——反应过程可逆(2)等——反应速率相等 v正=v逆(3)动——动态平衡,正逆反应仍在进行(4)定——反应混合物中各成分的含量(浓度、物质的量、百分组成等)一定(不再改变)(5)变——当外界条件改变时,化学平衡被破坏,在新的条件下达到新的平衡湖南省临澧县第一中学化学组 杜登高llyzddg@yahoo.com.cn第 138 页高三化学教案·第一轮复习第九单元化学反应速率 化学平衡(6)同——外界条件相同,反应不论是正向开始还是逆向开始,都会达到相同的平衡状态,即平衡只与条件有关,与反应的途径无关。5、化学平衡状态的特征(标志)(两者具其一即可)标志一:等 —— 正逆反应速率相等 v正=v逆标志二:定体系各组成含量(浓度、物质的量、百分组成等)一定,不再改变6、等效化学平衡体系在一定条件下,可逆反应无论是从正反应开始,还是从逆反应开始,达到平衡时,反应体系中各组成成分相同。如下图示:状态Ⅰ: m A + n Bp C + q D状态Ⅱ: m A + n Bp C + q D始态 C1 C2 0 0始态 0 0 C3 C4 (反应从正向开始)(反应从逆向开始)达到平衡 m A + n Bp C + q D平衡状态: C A(平) C B(平)C C(平)C D(平)(相同的平衡状态)(反应从某中间状态开始)状态Ⅲ: m A +...