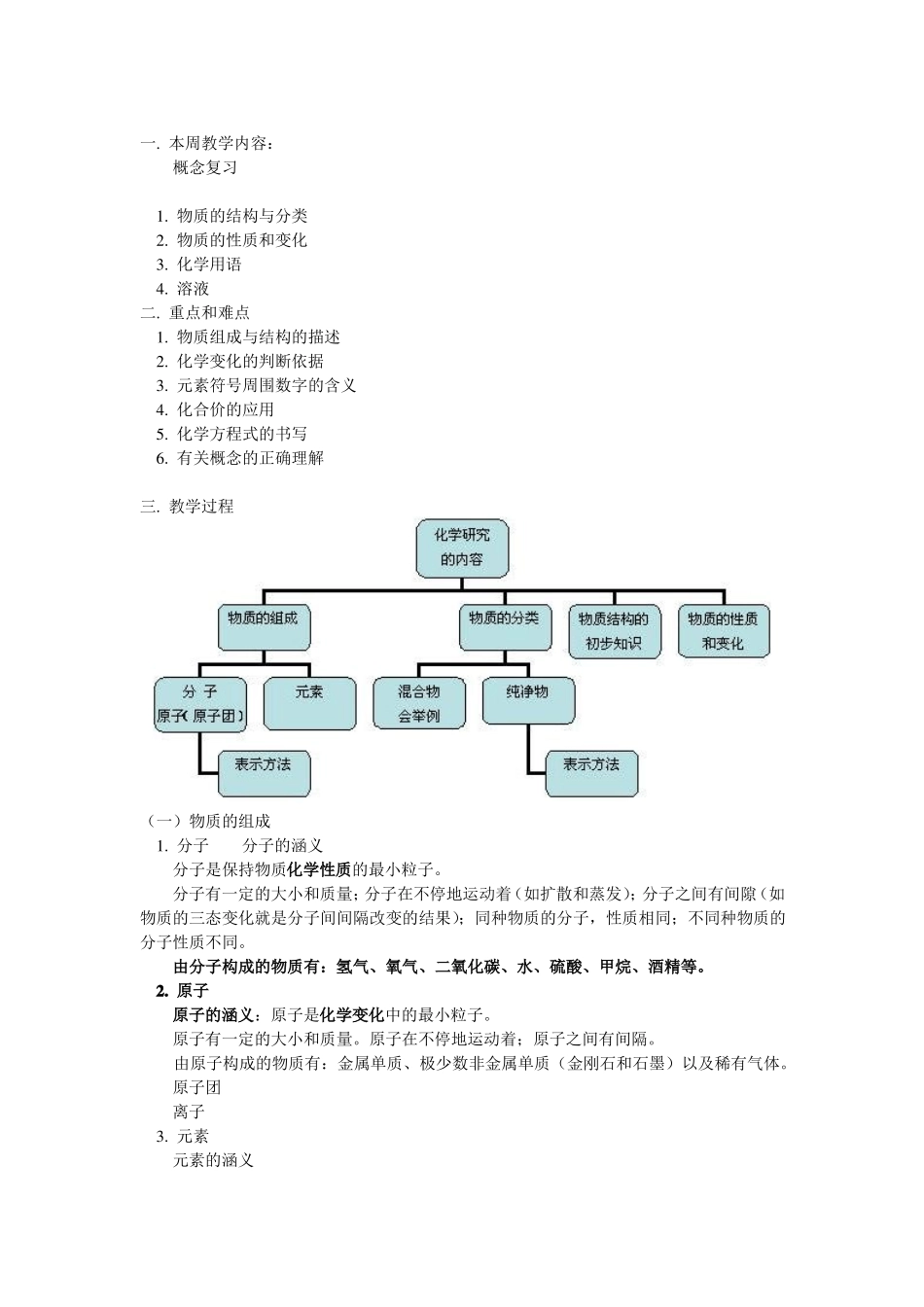
一. 本周教学内容:概念复习1. 物质的结构与分类2. 物质的性质和变化3. 化学用语4. 溶液二. 重点和难点1. 物质组成与结构的描述2. 化学变化的判断依据3. 元素符号周围数字的含义4. 化合价的应用5. 化学方程式的书写6. 有关概念的正确理解三. 教学过程(一)物质的组成1. 分子分子的涵义分子是保持物质化学性质的最小粒子。分子有一定的大小和质量;分子在不停地运动着(如扩散和蒸发);分子之间有间隙(如物质的三态变化就是分子间间隔改变的结果);同种物质的分子,性质相同;不同种物质的分子性质不同。由分子构成的物质有:氢气、氧气、二氧化碳、水、硫酸、甲烷、酒精等。2. 原子原子的涵义:原子是化学变化中的最小粒子。原子有一定的大小和质量。原子在不停地运动着;原子之间有间隔。由原子构成的物质有:金属单质、极少数非金属单质(金刚石和石墨)以及稀有气体。原子团离子3. 元素元素的涵义具有相同核电荷数(即核内质子数)的一类原子的总称。划分元素种类的依据:质子数(核电荷数)。元素分为金属元素、非金属元素和稀有气体元素。元素与原子的区别联系:只要是核电荷数相同的一类原子都属于同一种元素。(钠离子和钠原子)(二)物质结构的初步知识1. 原子的构成原子核(质子、中子)和核外电子原子是由居于原子中心带正电荷的原子核和核外带负电的电子构成的。原子核由质子和中子两种粒子构成。(氢原子核中只有质子没有中子)核外电子排布的初步知识核电荷数 = 质子数 = 核外电子数原子、离子的结构示意图会辨认。2. 化合价常见元素和原子团的化合价常见元素的化合价:常见原子团的化合价:根据化合价写化学式排元素或原子团的顺序:(一般)正价在左,负价在右;标出元素或原子团的化合价:(标在正上方)确定原子(或原子团)的个数:“约减交叉”根据化学式判断化合价由于化合物中正负化合价的代数和为零,可以求出其中某元素的化合价。(三)物质的分类1. 混合物、纯净物、单质、化合物混合物和纯净物①混合物:由两种或多种物质混合而成,没有发生化学变化。例如:空气、粗盐、溶液、石油等。※混合物各物质间不发生化学反应,它们各自保持原来的性质。②纯净物由一种物质组成。例如:氦气、氧气、氢气、二氧化碳、水、高锰酸钾等。注意:CuSO4·5H2O 属于纯净物。※能用一个化学式表示其组成的物质,一般都是纯净物。单质和化合物①单质:由同种元素组成的纯净物。例如:氢气、碳、铁、氦气等。...