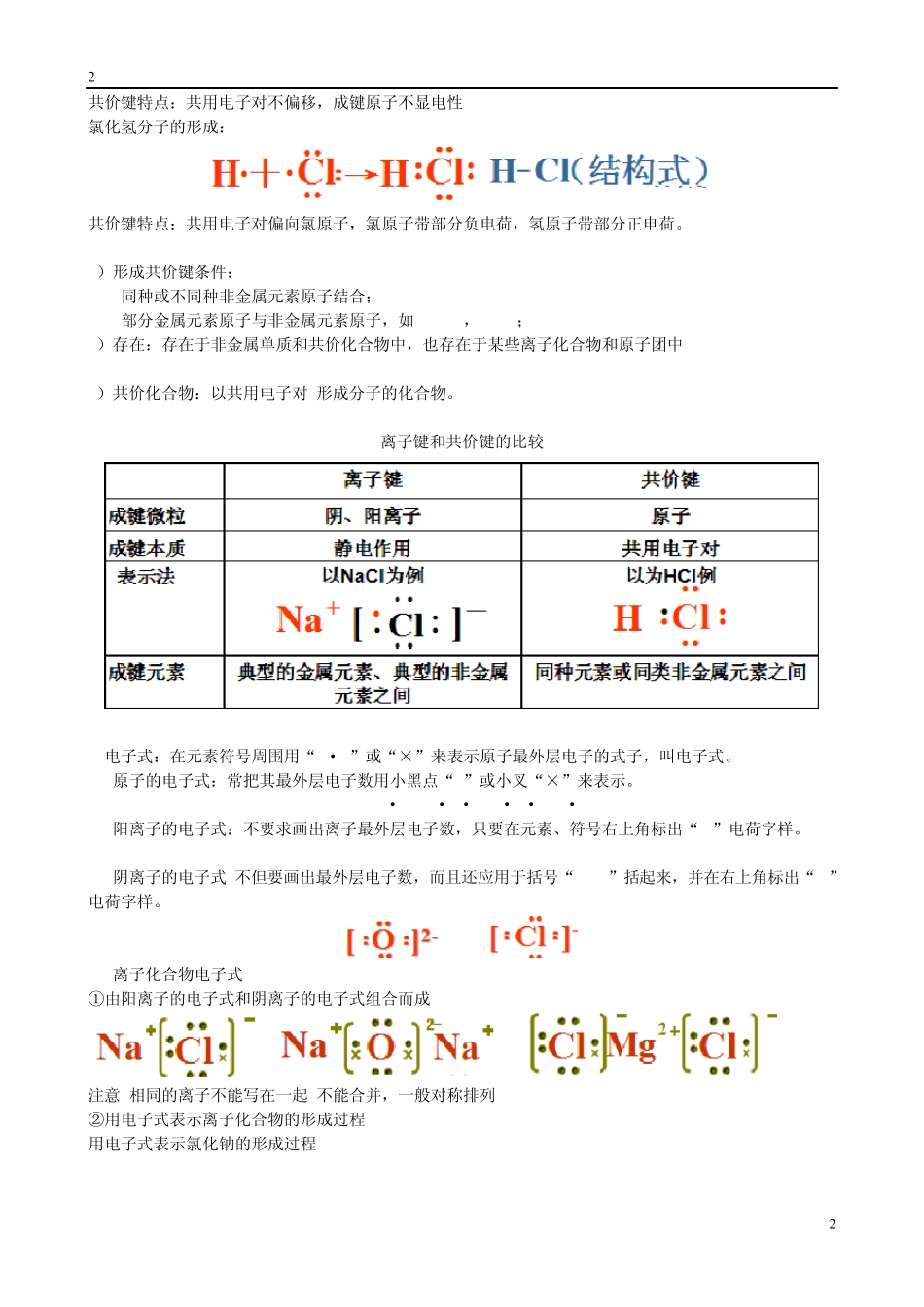
1 1 课题九 化学键和晶体结构 考点一:化学键 化学键:相邻原子之间强烈的相互作用叫化学键。 化学键的存在:①稀有气体单质中不存在; ②多原子单质分子中存在共价键; ③非金属化合物分子中存在共价键(包括酸); ④离子化合物中一定存在离子键,可能有共价键的存在(Na2O2、NaOH、NH4Cl),共价化合物中不存在离子键; ⑤离子化合物可由非金属构成,如:NH4NO3、NH4Cl 。 1.离子键 1)定义: 使阴阳离子结合成化合物的静电作用,叫做离子键。 成键微粒:阴阳离子 相互作用:静电作用(静电引力和斥力) 成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。 2)形成离子键的条件: ①活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间的化合物。 ②活泼的金属元素和酸根离子形成的盐酸根离子:SO42-、NO3-、Cl-等 ③铵盐子和酸根离子(或活泼非金属元素)形成的盐。把 NH4+看作是活泼的金属阳离子 ④离子化合物:含有离子键的化合物。 3)离子键的强弱比较 影响因素:离子半径(反比)、电荷数(正比) 比较离子键强弱:KCl与 KBr、 Na2O与 MgO 决定:稳定性及某些物理性质,如熔点等。 2.共价键 1)定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。 成键微粒:原子 相互作用:共用电子对 氢分子的形成: 2 2 共价键特点:共用电子对不偏移,成键原子不显电性 氯化氢分子的形成: 共价键特点:共用电子对偏向氯原子,氯原子带部分负电荷,氢原子带部分正电荷。 2)形成共价键条件: 同种或不同种非金属元素原子结合; 部分金属元素原子与非金属元素原子,如AlCl3 ,FeCl3; 3)存在:存在于非金属单质和共价化合物中,也存在于某些离子化合物和原子团中 H2 HCl NaOH NH4Cl Na2O2 SO42- NO3- 4)共价化合物:以共用电子对 形成分子的化合物。 离子键和共价键的比较 3.电子式:在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。 (1)原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。 H · Na · ·Mg · ·Ca · (2)阳离子的电子式:不要求画出离子最外层电子数,只要在元素、符号右上角标出“n+”电荷字样。 Ca2+ Mg2+ Na+ H+ (3)阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n-”电荷字样。 (4)离子化合物电子式 ①由阳离子的电子...