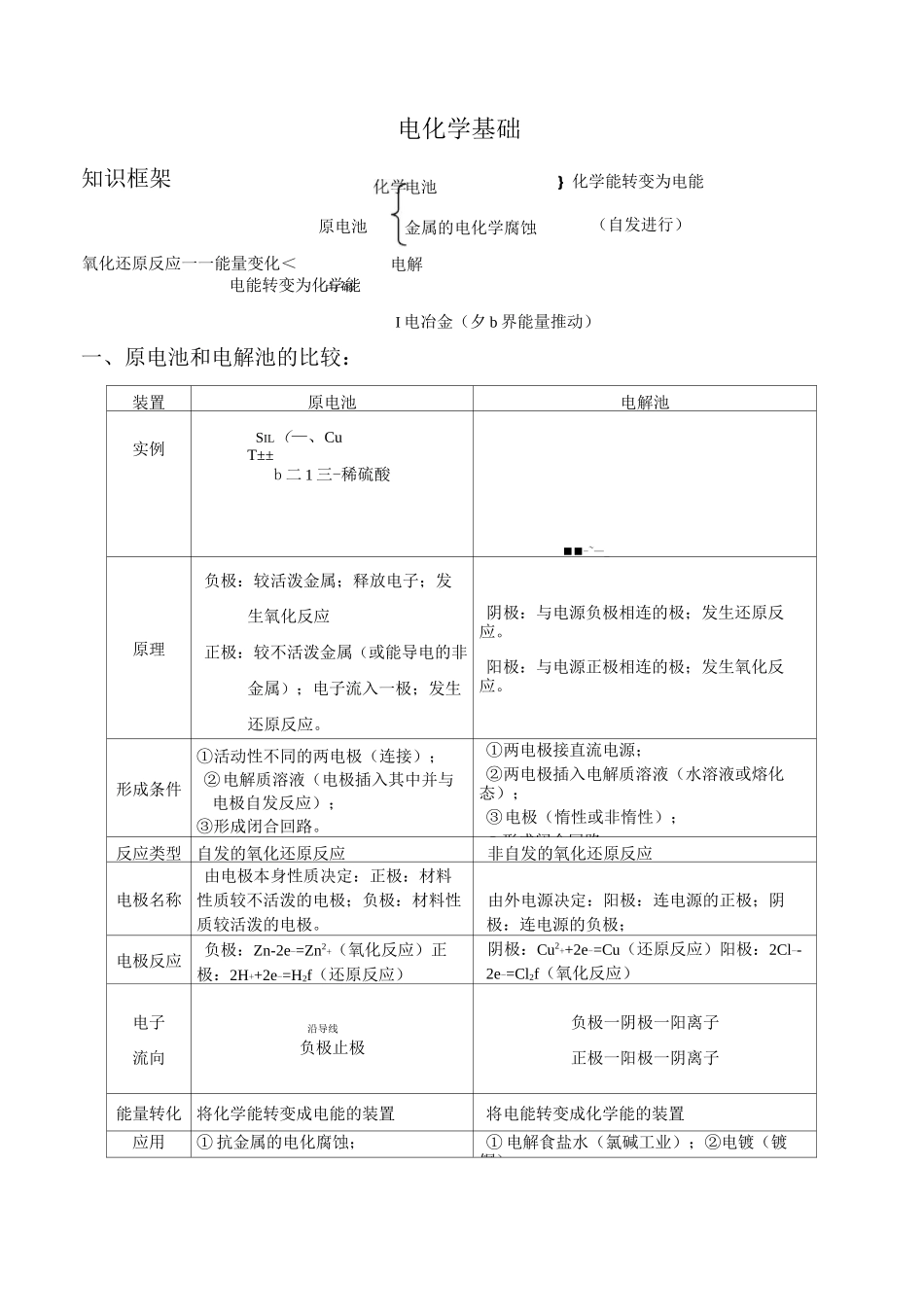
电解电能转变为化学能I 电冶金(夕 b 界能量推动)一、原电池和电解池的比较:装置原电池电解池实例SIL(—、CuT±±b 二 1 三-稀硫酸■■-~—_原理负极:较活泼金属;释放电子;发生氧化反应正极:较不活泼金属(或能导电的非金属);电子流入一极;发生还原反应。阴极:与电源负极相连的极;发生还原反应。阳极:与电源正极相连的极;发生氧化反应。形成条件①活动性不同的两电极(连接);②电解质溶液(电极插入其中并与电极自发反应);③形成闭合回路。①两电极接直流电源;②两电极插入电解质溶液(水溶液或熔化态);③电极(惰性或非惰性);Q 形成闭合回路。反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+(氧化反应)正极:2H++2e-=H2f(还原反应)阴极:Cu2++2e-=Cu(还原反应)阳极:2Cl--2e-=Cl2f(氧化反应)电子流向沿导线负极止极负极一阴极一阳离子正极一阳极一阴离子能量转化将化学能转变成电能的装置将电能转变成化学能的装置应用① 抗金属的电化腐蚀;① 电解食盐水(氯碱工业);②电镀(镀铜);知识框架氧化还原反应一一能量变化<电化学基础原电池电池金属的电化学腐蚀}化学能转变为电能(自发进行)电解② 实用电池。③ 电冶(冶炼 Na、Mg、Al);④精炼(精铜)。二、原电池电极反应式和总反应式的书写:1 书写方法:(1)先写出电池反应(对于简单的电池反应,复杂的电池反应考试往往是已知的)(2)标出反应前后元素化合价变化(3)找出氧化剂和还原剂、氧化产物和还原产物,确定电极反应的反应物及生成物(4)根据化合价的升降数确定得或失的电子数(5)配平电极反应式(注意考虑电解质溶液的性质,常需考虑 H+、OH-、H2O)(6)可根据电极反应或电池反应分析两极及电解质溶液的变化等2 书写方法步骤以铅蓄电池放电时的反应为例,总反应为 Pb+PbO2+2H2SO4====2PbSO4+2H2O,电极反应式的书写步骤如下:负极:Pb-2e-====PbS0”—左边补充 so:-_>Pb+SO2--2e-====PbS0”4444正极:PbO2+2e-====PbSO4——左边补充 so]-_>PbO2+SOj-+2e-====PbSO4结合反应式判断氧元—去向”>PbO2+4H++SOr+2e-====PbSO4+2H2O。(也可用总反应式减去负极反应式得到正极反应式)【例 1】(09 福建卷 11)控制适合的条件,将反应2Fe3++21--...