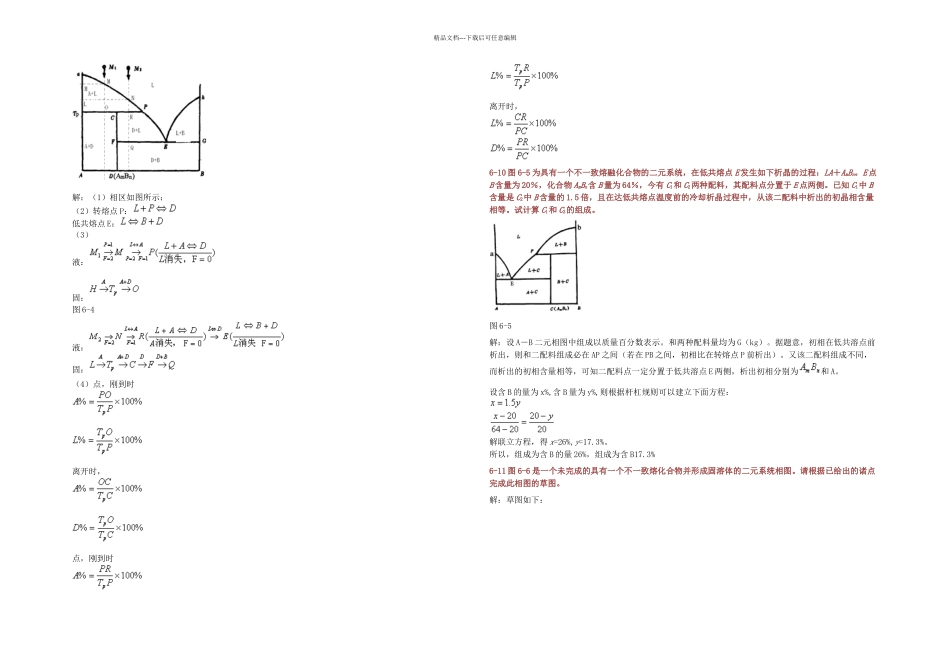
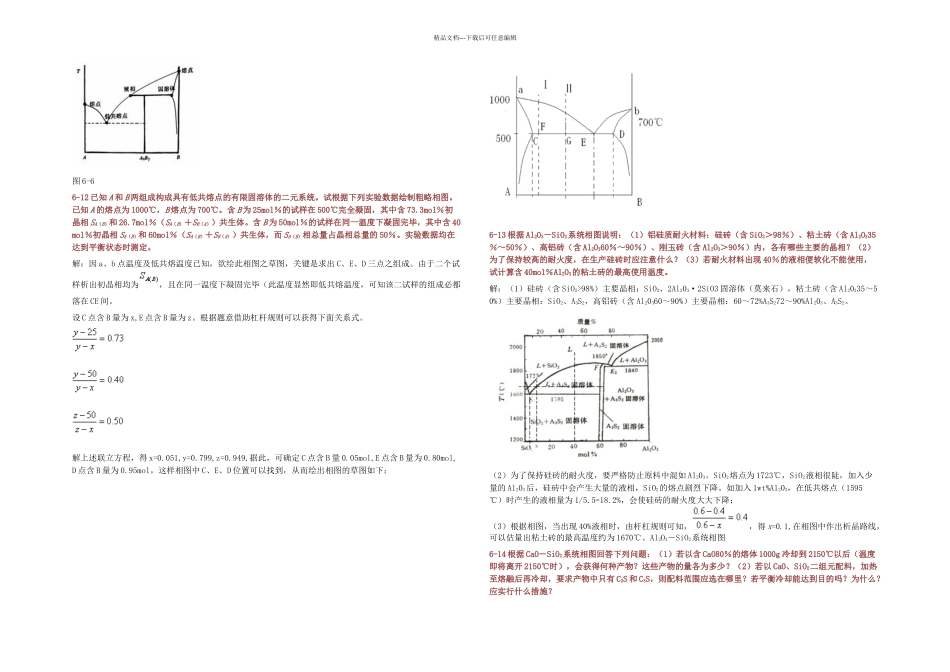
精品文档---下载后可任意编辑6-1 略。6-2 什么是吉布斯相律?它有什么实际意义?解:相律是吉布斯根据热力学原理得出的相平衡基本定律,又称吉布斯相律,用于描述达到相平衡时系统中自由度数与组分数和相数之间的关系。一般形式的数学表达式为 F=C-P+2。其中 F 为自由度数,C 为组分数,P 为相数,2 代表温度和压力两个变量。应用相率可以很方便地确定平衡体系的自由度数。6-3 固体硫有两种晶型,即单斜硫、斜方硫,因此,硫系统可能有四个相,假如某人实验得到这四个相平衡共存,试推断这个实验有无问题?解:有问题,根据相律,F=C-P+2=1-P+2=3-P,系统平衡时,F=0,则 P=3,硫系统只能是三相平衡系统。图 6-1 图 6-26-4 如图 6-1 是钙长石(CaAl2Si2O)的单元系统相图,请根据相图回解:(1)六方、正交和三斜钙长石的熔点各是多少?(2)三斜和六方晶型的转变是可逆的还是不可逆的?你是如何推断出来的?(3)正交晶型是热力学稳定态?还是介稳态?解:(1)六方钙长石熔点约 1300℃(B 点),正钙长石熔点约 1180℃(C 点),三斜钙长石的熔点约为 1750℃(A 点)。(2)三斜与六方晶型的转变是可逆的。因为六方晶型加热到转变温度会转变成三斜晶型,而高温稳定的三斜晶型冷却到转变温度又会转变成六方晶型。(3)正交晶型是介稳态。6-5 图 6-2 是具有多晶转变的某物质的相图,其中 DEF 线是熔体的蒸发曲线。KE 是晶型 I 的升华曲线;GF是晶型 II 的升华曲线;JG 是晶型 III 的升华曲线,回答下列问题:(1)在图中标明各相的相区,并写出图中各无变量点的相平衡关系;(2)系统中哪种晶型为稳定相?哪种晶型为介稳相?(3)各晶型之间的转变是可逆转变还是不可逆转变?解:(1)KEC 为晶型Ⅰ的相区,EFBC 过冷液体的介稳区,AGFB 晶型Ⅱ的介稳区,JGA 晶型Ⅲ的介稳区,CED 是液相区,KED 是气相区;(2)晶型Ⅰ为稳定相,晶型Ⅱ、Ⅲ为介稳相;因为晶型Ⅱ、Ⅲ的蒸汽压高于晶型Ⅰ的,即它们的自由能较高,有自发转变为自由能较低的晶型Ⅰ的趋势;(3)晶型Ⅰ转变为晶型Ⅱ、Ⅲ是单向的,不可逆的,多晶转变点的温度高于两种晶型的熔点;晶型Ⅱ、Ⅲ之间的转变是可逆的,双向的,多晶转变点温度低于Ⅱ、Ⅲ的熔点。6-6 在 SiO2系统相图中,找出两个可逆多晶转变和两个不可逆多晶转变的例子。解:可逆多晶转变:β-石英←→α-石英 α-石英←→α-鳞石英不可逆多晶转变:β-方石英←→β-石英 γ-...