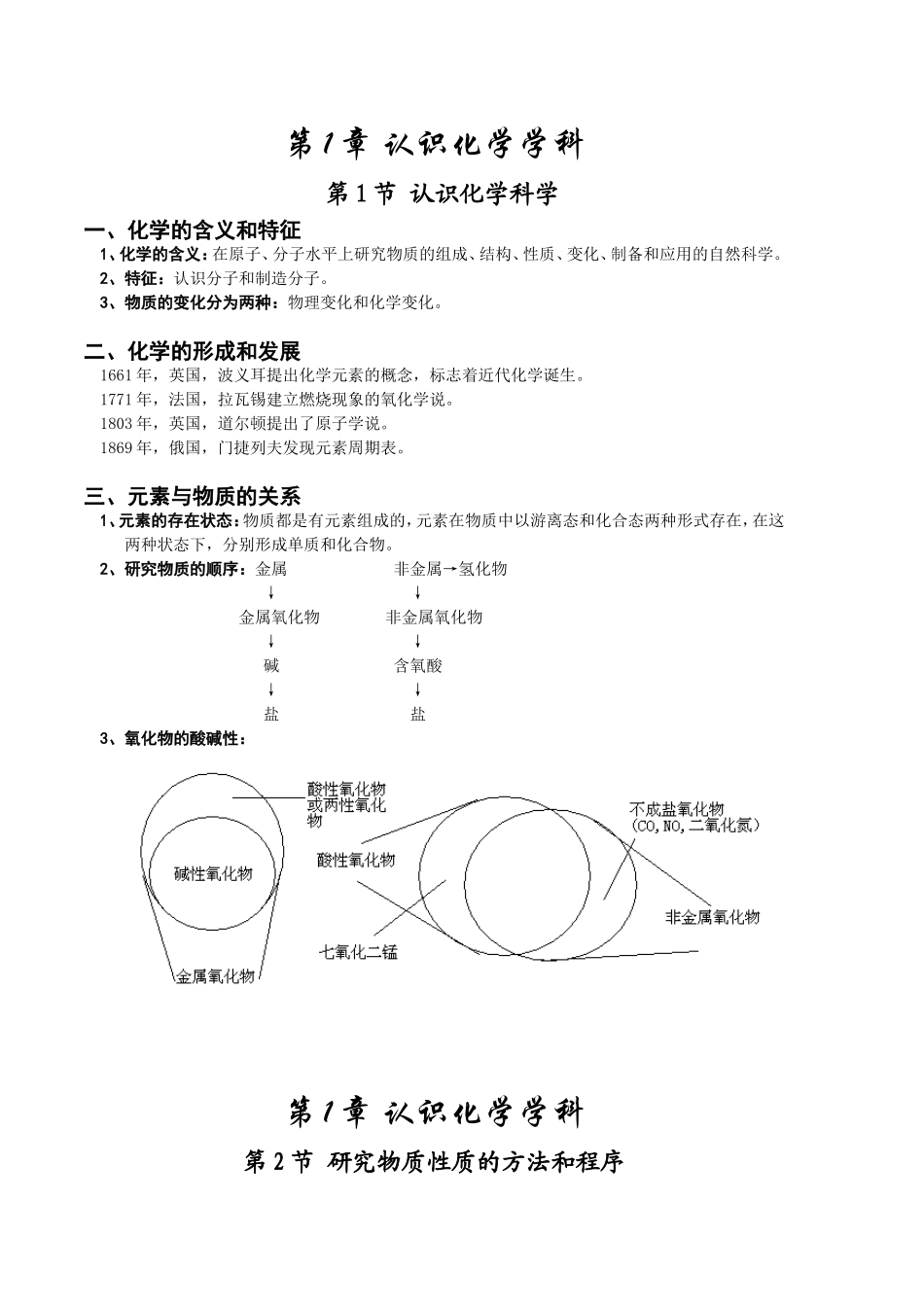
第1章认识化学学科第1节认识化学科学一、化学的含义和特征1、化学的含义:在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。2、特征:认识分子和制造分子。3、物质的变化分为两种:物理变化和化学变化。二、化学的形成和发展1661年,英国,波义耳提出化学元素的概念,标志着近代化学诞生。1771年,法国,拉瓦锡建立燃烧现象的氧化学说。1803年,英国,道尔顿提出了原子学说。1869年,俄国,门捷列夫发现元素周期表。三、元素与物质的关系1、元素的存在状态:物质都是有元素组成的,元素在物质中以游离态和化合态两种形式存在,在这两种状态下,分别形成单质和化合物。2、研究物质的顺序:金属非金属→氢化物↓↓金属氧化物非金属氧化物↓↓碱含氧酸↓↓盐盐3、氧化物的酸碱性:第1章认识化学学科第2节研究物质性质的方法和程序一、研究物质的基本方法:观察、实验、分类、比较等方法。(一)Na的性质1、物理性质:钠是一种银白色金属,熔点为97.8℃,沸点为882.9℃,密度为0.97g/cm3。2、化学性质:容易失去一个电子,形成Na+(稳定结构),还原性极强。(1)与非金属反应:①4Na+O2====2Na2O②2Na+O2====Na2O2③2Na+Cl2====2NaCl④2Na+S====Na2S(2)与水反应:2Na+2H2O====2NaOH+H2↑现象:浮:Na浮在水面上;熔:融化成一个小球;游:四处游动;响:发出咝咝响声;红:试液变红。(3)与酸反应:2Na+2HCl====2NaCl+H2↑(4)与盐反应:①2Na+2H2O+CuSO4====Cu(OH)2↓+Na2SO4+H2↑②6Na+6H2O+2FeCl3====2Fe(OH)3↓+6NaCl+3H2↑③4Na+TiCl4(熔融状)Ti+4NaCl(5)Na在空气中的一系列变化:NaNa2ONaOHNa2CO3·10H2ONa2CO34Na+O2====2Na2O→Na2O+H2O====2NaOH→2NaOH+9H2O+CO2====Na2CO3·10H2O→Na2CO3·10H2ONa2CO3+10H2O↑3、Na的保存:钠通常保存在煤油或石蜡油中。4、Na的用途:钠和钾的合金可用作原子反应堆的导热剂;高压钠灯;金属冶炼。(二)Na2O的性质1、物理性质:白色固体,不可燃。2、化学性质:(1)与水反应:Na2O+H2O====2NaOH(2)与酸反应:Na2O+2HCl====2NaCl+H2O(3)与非金属反应:Na2O+CO2====Na2CO33、Na2O的用途:制NaOH,Na2CO3(三)Na2O2的性质1、物理性质:淡黄色固体。2、化学性质:(1)与水反应:2Na2O2+2H2O====4NaOH+O2↑(放出大量的热)(2)与非金属反应:2Na2O2+2CO2====2Na2CO3+O2↑(放出大量的热)(3)与酸反应:2Na2O2+4HCl====4NaCl+2H2O+O2↑3、Na2O2的用途:作供氧剂、漂白剂、强氧化剂【向NaOH溶液中通入CO2气体至过量】:无明显现象,加热溶液后生成气体。2NaOH+CO2====Na2CO3+H2O+O2↑→2NaHCO3Na2CO3+H2O+CO2↑【向Ca(OH)2溶液中通入CO2气体至过量】:先生成沉淀,后沉淀消失,加热溶液后生成沉淀和气体。Ca(OH)2+CO2====CaCO3↓+H2O→CaCO3+H2O+CO2===Ca(HCO3)2→Ca(HCO3)2CaCO3↓+H2O+CO2↑二、研究物质的基本程序:观察物质外观→预测物质性质实验和观察→解释和结论点燃点燃点燃进一步研究↓↑发现特殊现象,提出新问题(一)氯气的性质1、物理性质:黄绿色气体,有刺激性气味,有毒,能溶于水,易液化,密度大与空气。2、化学性质:(1)与金属反应:①与钠反应:2Na+Cl22NaCl剧烈燃烧,黄色火焰、生成白烟。②与铁反应:2Fe+3Cl22FeCl3剧烈燃烧,生成棕褐色/红褐色烟。③与铜反应:Cu+Cl2CuCl2剧烈燃烧,生成棕黄色烟。规律:变价金属与Cl2反应一般生成高价金属的氧化物。(2)与非金属反应:①氢气在氯气中燃烧:H2+Cl22HCl苍白色火焰,瓶口内壁出现白雾。②氢气与氯气混合光照:H2+Cl22HCl发生爆炸。(3)与水反应:Cl2+H2O===HCl+HClO新制氯水中的微粒(4)与碱反应:①2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O2Cl2+2H2O====2HCL+2HClO2HCl+Ca(OH)2====CaCl2+2H2O2HClO+Ca(OH)2====Ca(ClO)2+2H2O②Cl2+2NaOH====NaCl+NaClO+H2OCl2+H2O====HCl+HClOHCl+NaOH====NaCl+H2OHClO+NaOH====NaClO+H2O(5)与盐反应:Cl2+2KI====2KCl+I2Cl2+2NaBr====NaCl+Br23、氯气的用途:用来制造盐酸、有机溶解剂和杀菌消毒剂。(二)HClO的性质1、不稳定性:2HClO2HCl+O2↑2、强氧化性:漂白粉和消毒剂的主要成分:Ca...