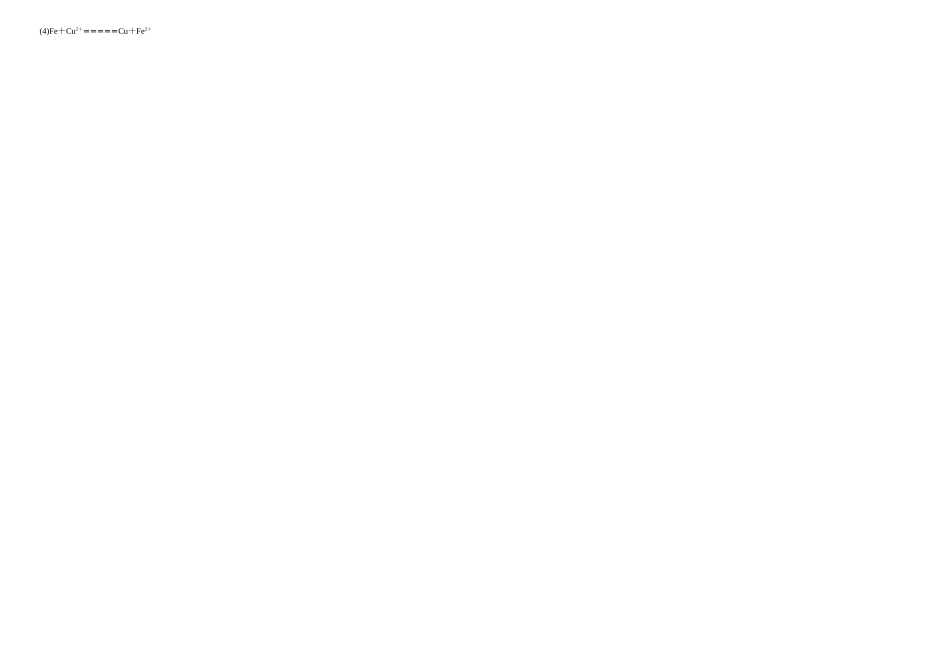知识点总结三·金属的腐蚀与防护知识点1·金属的腐蚀1.金属腐蚀的概念(1)金属的腐蚀是指金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。(2)金属腐蚀的实质:金属原子失去电子被氧化的过程,M-ne-===Mn+(M表示金属)(3)金属腐蚀的类型:化学腐蚀和电化学腐蚀表1化学腐蚀与电化学腐蚀化学腐蚀电化学腐蚀条件金属或合金直接与具有腐蚀性的化学物质接触发生氧化还原反应而消耗的过程不纯的金属或合金与电解质溶液接触发生原电池反应,使较活泼的金属失去电子被氧化而消耗的过程腐蚀对象金属被氧化金属或合金中较活泼的金属被氧化联系两者往往同时发生,电化学腐蚀更普遍、危害性更大、腐蚀速率更快2.钢铁的腐蚀(1)化学腐蚀:4Fe+3O2+2nH2O===2Fe2O3·nH2O(2)电化学腐蚀:吸氧腐蚀和析氢腐蚀①吸氧腐蚀通常情况下,在潮湿的空气中,钢铁的表面凝结了一层溶有氧气的水膜,这层水膜、铁和铁中存在少量碳单质形成了无数微小的原电池。这些微小的原电池遍布钢铁表面。当周围环境呈若酸性或中性时,发生“吸氧腐蚀”。负极:;正极:。总反应:。上述电化学腐蚀中吸收氧气,故称为吸氧腐蚀。②析氢腐蚀当钢铁表面水膜呈较强的酸性时,正极析出氢气发生“析氢腐蚀”负极:;正极:。总反应:。上述电化学腐蚀会生成氢气,故称为析氢腐蚀。(3)铁锈的生成铁锈的主要成分:Fe2O3·nH2O钢铁在中性或弱酸性条件下发生吸氧腐蚀后,生成的氢氧化亚铁会进一步被O2氧化,生成氢氧化铁,氢氧化铁部分脱水生成Fe2O3·nH2O(铁锈的主要成分)。主要的化学方程式:4Fe(OH)2+2H2O+O2==4Fe(OH)32Fe(OH)3==Fe2O3·nH2O+(3-n)H2O知识点2·金属的防护1.金属防护的原理金属腐蚀的实质是金属原子失去电子被氧化的过程。防止金属被腐蚀,就是阻断金属发生氧化反应的途径。2.金属防护的常用方法:(1)改变金属组成或结构如:将铬、镍加入普通钢里制成不锈钢。(2)在金属表面覆盖保护层原理:隔绝金属与外界空气、电解质溶液的接触。这样的表面保护常用的方法主要有金属表面涂层保护和镀层保护。如:在钢铁表面涂上油漆或油脂、覆盖塑料、镀锌等。(3)电化学防护法金属的电化学防护是利用电化学原理来保护金属,防止金属腐蚀。牺牲阳极的阴极保护法外加电流的阴极保护法依据原电池原理电解池原理原理形成原电池时,被保护金属做正极(阴极)被保护;更活泼金属做负极(阳极)被氧化被保护的金属与电源负极相连,充当阴极;另一惰性材料与电源的正极相连,充当阳极应用保护一些钢铁设备,如锅炉内壁、船体外壳等装有镁合金或锌片保护土壤、海水及水中的金属设备图示知识点3·金属腐蚀快慢的规律1.对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀(或者:电解池的阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极)2.对同一金属来说,在同一溶液中腐蚀速率的快慢:强电解质溶液中>若电解质溶液中>非电解质溶液中3.活动性不同的两种金属,活动性差别越大,腐蚀越快。4.对同一种电解质溶液来说,电解质溶液浓度越大,金属腐蚀越快。5.纯度越高的金属,腐蚀的速率越慢。6.不纯的金属或合金,在潮湿空气中的腐蚀速率远大于在干燥、隔绝空气条件下的腐蚀速率。防腐措施由好到坏的顺序:外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件的保护法>无防腐条件补充你的知识点或写出你的疑惑:化学能与电能的转化·练习题一、选择题1.下列各装置能构成原电池的是()2.对于原电池的电极名称,叙述错误的()A.发生氧化反应的一极为负极B.正极为电子流入的一极C.比较不活泼的金属为负极D.电流流出的一极为正极3.根据下列事实:①X+Y2+===X2++Y②Z+2H2O(冷)===Z(OH)2+H2↑③Z2+的氧化性比X2+弱④由Y、W两电极组成的原电池电极反应为:W2++2e-===W;Y-2e-===Y2+。可知X、Y、W、Z的还原性由强到弱的顺序是()A.X>Z>Y>WB.Z>W>X>YC.Z>Y>X>WD.Z>X>Y>W4.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()A.两烧杯中铜片表面均无气泡产生B.甲中铜片是正极,乙中铜片是负极C.两...