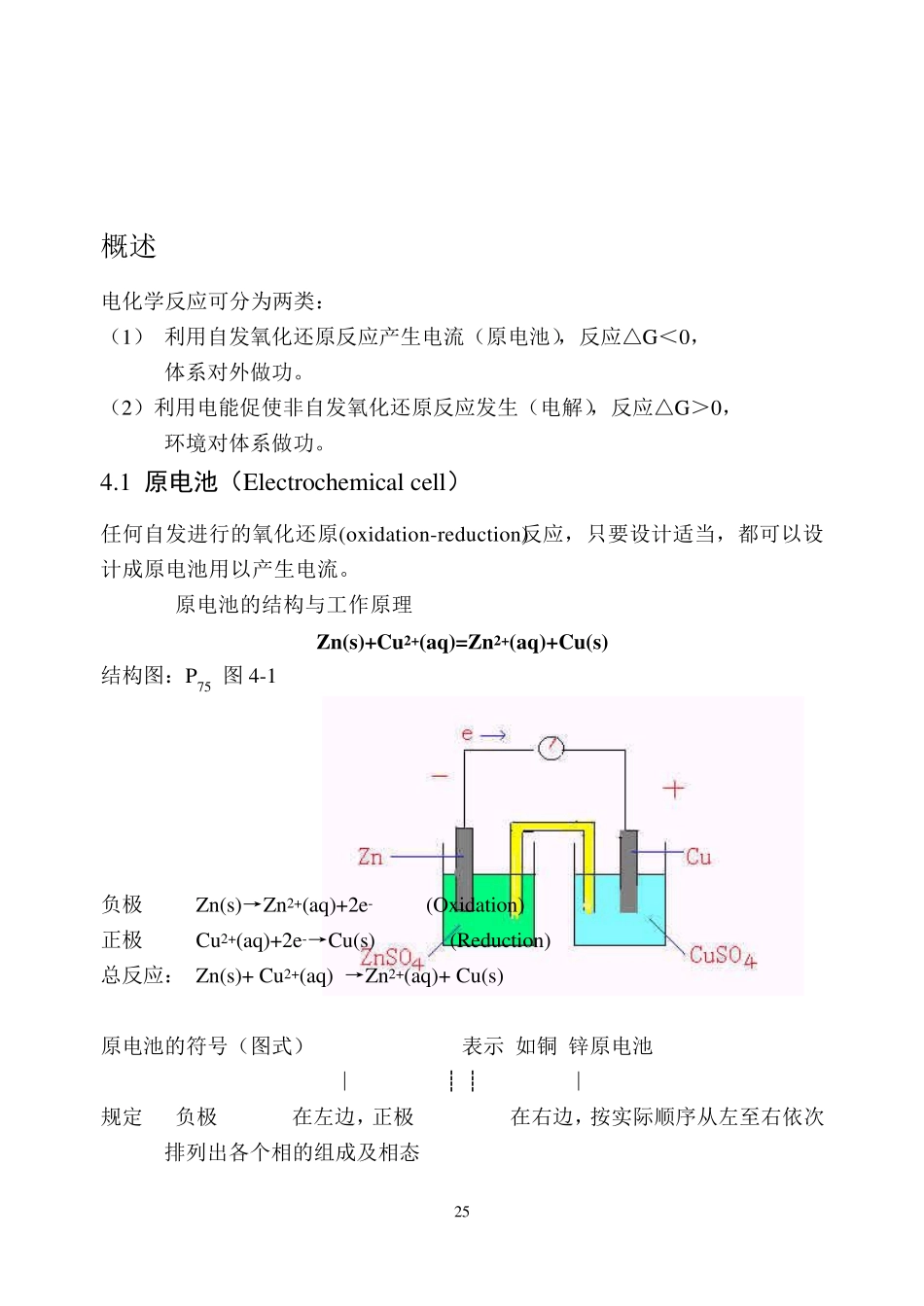
24 第4章 电化学原理及应用(讲授5学时) Chapter 4 Electrochemistry 本章教学内容: 原电池与电极电势。能斯特方程式的应用。E 与△rGm 的关系。氧化还原反应方向的判断。用△ rGθ m,Eθ 与Kθ 估计氧化还原反应进行的程度。化学电源,蓄电池、新型燃料电池、高能电池、电解、电镀、电抛光、电解加工,金属的腐蚀及防护。 本章教学要求: (1) 了解电极电势的概念,能用能斯特方程式进行有关计算 (2) 能应用电极电势的数据判断氧化剂还原剂的相对强弱及氧化还原反应自发进行的方向和程度。了解摩尔吉布斯焓变与原电池电动势,标准摩尔吉布斯自由能变与氧化还原反应平衡常数的关系。 (3) 了解电解、电镀、电抛光的基本原理,了解它们在工程上的应用。 (4) 了解金属腐蚀及防护原理. 本章教学重点: a) 原电池的组成、半反应式以及电极类型; b) 电极电势的概念,能斯特方程式及电极电势的应用; c) 电解基本原理及应用,电镀、电抛光、电解加工; d) 金属腐蚀及防护原理。 本章习题: P97 1, 2, 5, 6, 7, 9, 10 25 概述 电化学反应可分为两类: (1) 利用自发氧化还原反应产生电流(原电池),反应△G<0, 体系对外做功。 (2)利用电能促使非自发氧化还原反应发生(电解),反应△G>0, 环境对体系做功。 4.1 原电池(Electrochemical cell) 任何自发进行的氧化还原(ox idation-redu ction)反应,只要设计适当,都可以设计成原电池用以产生电流。 4.1.1 原电池的结构与工作原理 Zn(s)+Cu 2+(aq)=Zn2+(aq)+Cu (s) 结构图:P75 图4-1 负极 Zn(s)→Zn2+(aq)+2e- (Ox idation) 正极 Cu 2+(aq)+2e-→Cu (s) (Redu ction) 总反应: Zn(s)+ Cu 2+(aq) →Zn2+(aq)+ Cu (s) 原电池的符号(图式)(cell diagram)表示:如铜-锌原电池, : Zn∣ZnSO4(c1)┊┊CuSO4(c2)∣Cu 规定(1)负极(anode)在左边,正极(Cathode)在右边,按实际顺序从左至右依次排列出各个相的组成及相态; 26 (2)用单实竖线 表示相界面,用双虚竖线 表示盐桥; (3)溶液注明浓度,气体注明分压; (4)若溶液中含有两种离子参加电极反应,可用逗号隔开,并加上惰性电极. 4.1.2 电极类型 按氧化态、还原态物质的状态分类: ·第一类,金属、或吸附了气体的惰性金属放在含该元素离子的溶液中 ·第二类,金属难溶盐(难溶氧化物) ·第三类,电极为惰性材料,运输电子。 4.2 电极电势 4.2.1 双电...