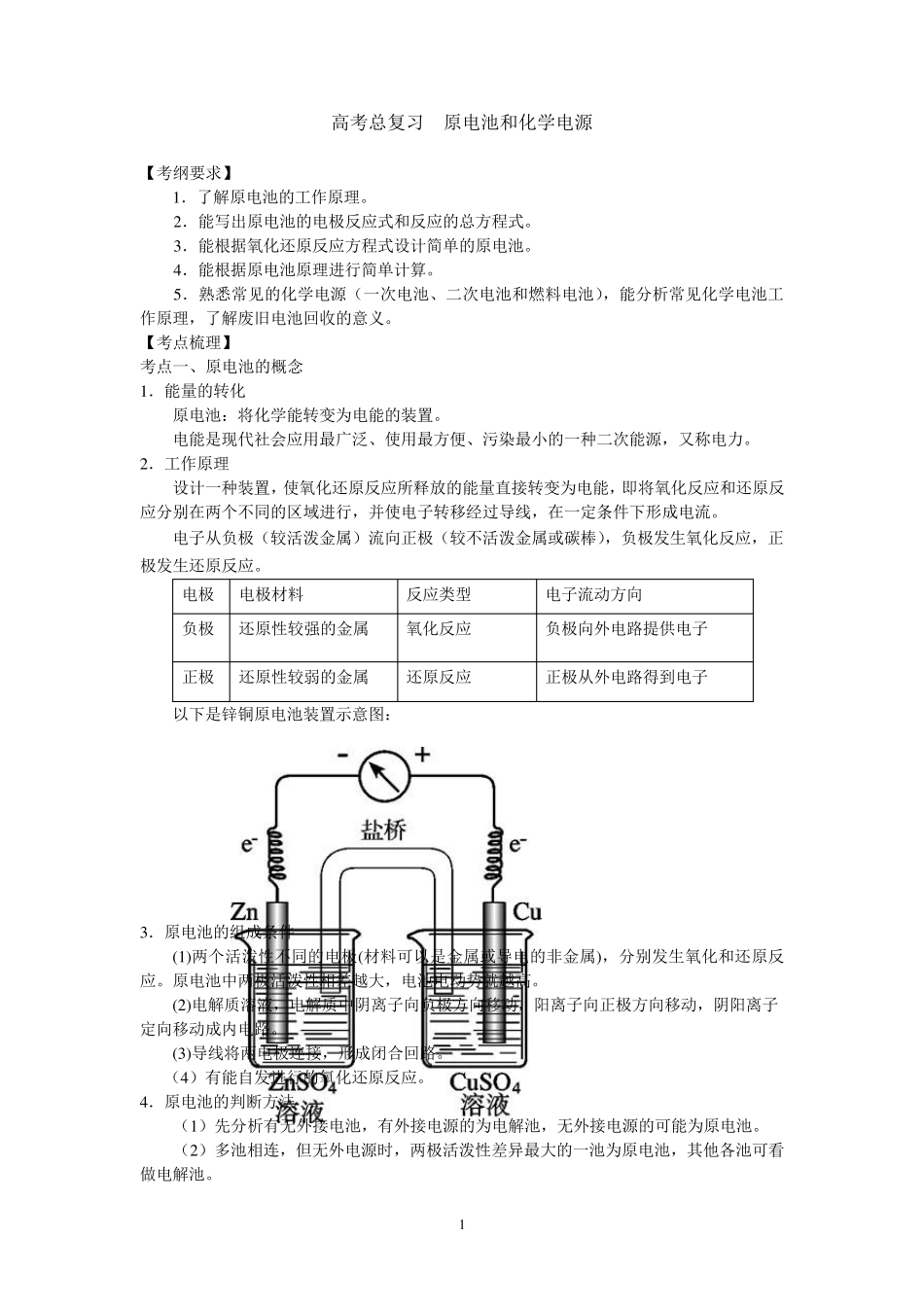
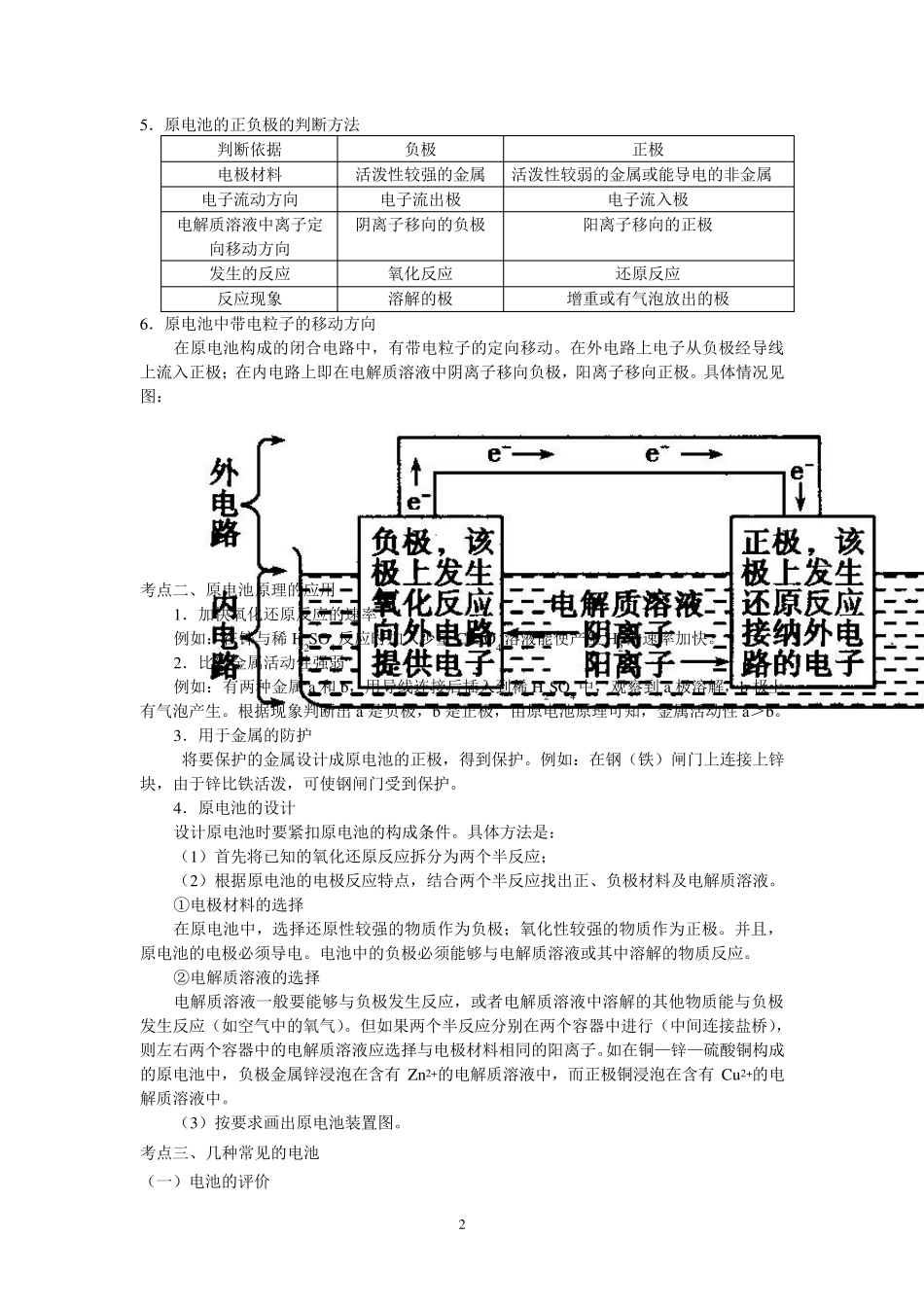
1 高考总复习 原电池和化学电源 【考纲要求】 1 .了解原电池的工作原理。 2 .能写出原电池的电极反应式和反应的总方程式。 3 .能根据氧化还原反应方程式设计简单的原电池。 4 .能根据原电池原理进行简单计算。 5 .熟悉常见的化学电源(一次电池、二次电池和燃料电池),能分析常见化学电池工作原理,了解废旧电池回收的意义。 【考点梳理】 考点一、原电池的概念 1 .能量的转化 原电池:将化学能转变为电能的装置。 电能是现代社会应用最广泛、使用最方便、污染最小的一种二次能源,又称电力。 2 .工作原理 设计一种装置,使氧化还原反应所释放的能量直接转变为电能,即将氧化反应和还原反应分别在两个不同的区域进行,并使电子转移经过导线,在一定条件下形成电流。 电子从负极(较活泼金属)流向正极(较不活泼金属或碳棒),负极发生氧化反应,正极发生还原反应。 电极 电极材料 反应类型 电子流动方向 负极 还原性较强的金属 氧化反应 负极向外电路提供电子 正极 还原性较弱的金属 还原反应 正极从外电路得到电子 以下是锌铜原电池装置示意图: 3 .原电池的组成条件 (1 )两个活泼性不同的电极(材料可以是金属或导电的非金属),分别发生氧化和还原反应。原电池中两极活泼性相差越大,电池电动势就越高。 (2 )电解质溶液,电解质中阴离子向负极方向移动,阳离子向正极方向移动,阴阳离子定向移动成内电路。 (3 )导线将两电极连接,形成闭合回路。 (4 )有能自发进行的氧化还原反应。 4 .原电池的判断方法 (1 )先分析有无外接电池,有外接电源的为电解池,无外接电源的可能为原电池。 (2 )多池相连,但无外电源时,两极活泼性差异最大的一池为原电池,其他各池可看做电解池。 2 5.原电池的正负极的判断方法 判断依据 负极 正极 电极材料 活泼性较强的金属 活泼性较弱的金属或能导电的非金属 电子流动方向 电子流出极 电子流入极 电解质溶液中离子定向移动方向 阴离子移向的负极 阳离子移向的正极 发生的反应 氧化反应 还原反应 反应现象 溶解的极 增重或有气泡放出的极 6.原电池中带电粒子的移动方向 在原电池构成的闭合电路中,有带电粒子的定向移动。在外电路上电子从负极经导线上流入正极;在内电路上即在电解质溶液中阴离子移向负极,阳离子移向正极。具体情况见图: 考点二、原电池原理的应用 1.加快氧化还原反应的速率 例如:在锌与稀 H2S...