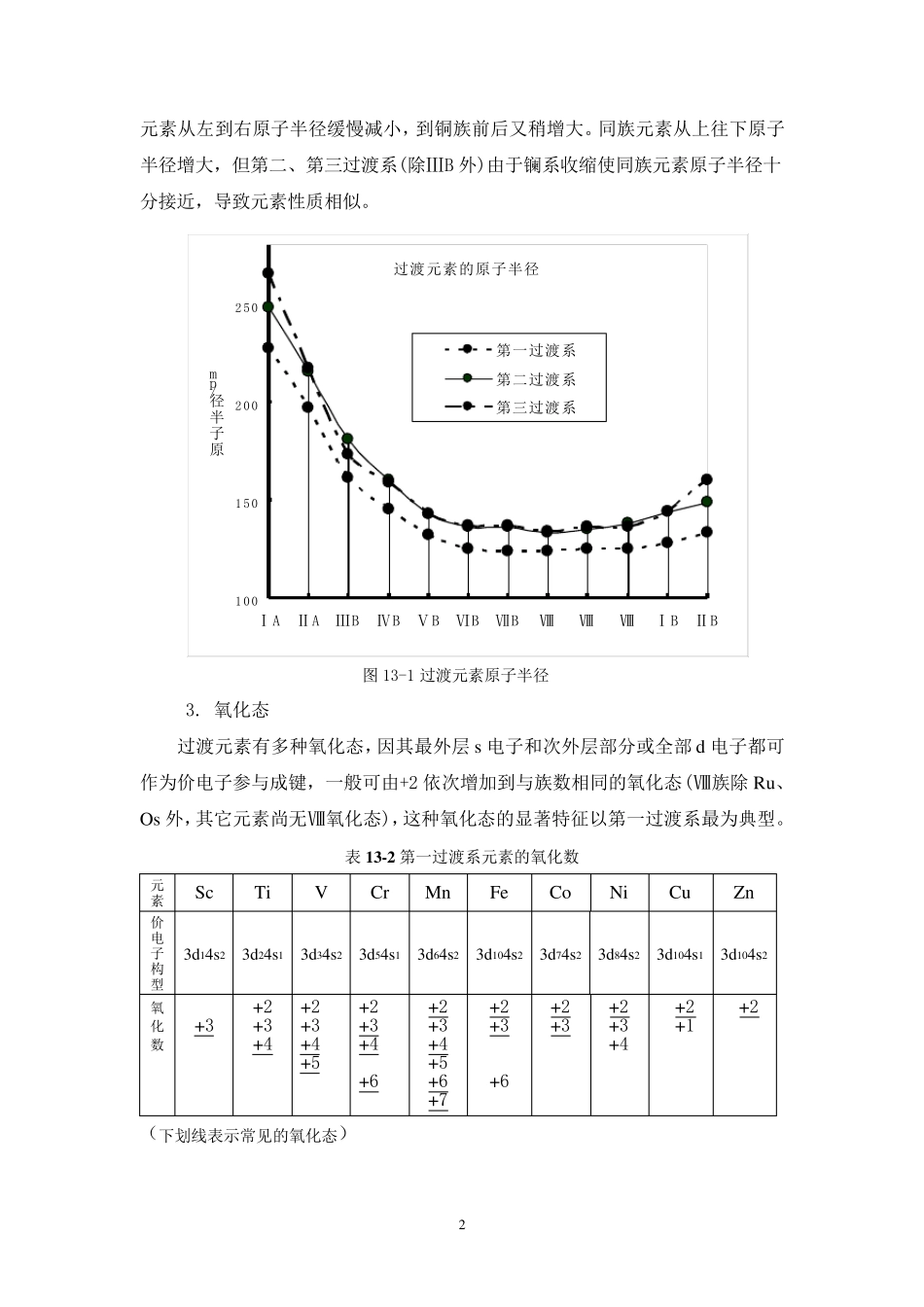
1 第十三章 过渡元素(一)铜族和锌族 【内容】 13.1 过渡元素的通性 13.2 铜族元素 13.3 锌族元素 13.4 应用 微量元素与人体健康(选学内容) 【要求】 1.掌握铜、银、锌、汞单质、氧化物、氢氧化物、重要盐类及配合物的生成、性质和用途。 2.掌握Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化。 3.了解ⅠA 和ⅠB;ⅡA 和ⅡB 族元素的性质对比。 周期表中ⅠB ⅧB 族,即 ds 区和d 区元素称为过渡元素,(见表 13﹣1)。它们位于周期表中部,处在 s 区和p 区之间,故而得名,它们都是金属,也称过渡金属。 表 13-1 过渡元素 ⅢB ⅣB ⅤB ⅥB ⅦB ⅧB ⅠB ⅡB Sc Ti V Cr Mn Fe Co Ni Cu Zn Y Zr Nb Mo Tc Ru Rh Pd Ag Cd La Hf Ta W Re Os Ir Pt Au Hg Ac Rf Db Sg Bh Hs Mt 通常按周期将过渡元素分成三个过渡系列:位于第 4 周期的Sc Zn 称第一过渡系元素;第 5 周期的Y Cd 为第二过渡系元素;第6 周期的La Hg 为第三过渡系元素。过渡元素有许多共同性质,本章先讨论它们的通性,然后介绍ⅠB 及ⅡB 族元素。 13.1 过渡元素的通性 1.价层电子构型 过渡元素原子的最后一个电子排布在次外层的d 轨道(ⅡB 除外)中,最外层有 12 个 s (Pd 除外)电子,它们的价层电子构型为(n-1)d1~10ns1~2。 2. 原子半径 过渡元素原子半径(如图 13-1 所示)一般比同周期主族元素的小,同周期 2 元素从左到右原子半径缓慢减小,到铜族前后又稍增大。同族元素从上往下原子半径增大,但第二、第三过渡系(除ⅢB 外)由于镧系收缩使同族元素原子半径十分接近,导致元素性质相似。 图13-1 过渡元素原子半径 3. 氧化态 过渡元素有多种氧化态,因其最外层s 电子和次外层部分或全部d 电子都可作为价电子参与成键,一般可由+2 依次增加到与族数相同的氧化态(Ⅷ族除Ru、Os 外,其它元素尚无Ⅷ氧化态),这种氧化态的显著特征以第一过渡系最为典型。 表1 3 -2 第一过渡系元素的氧化数 元素 Sc Ti V Cr Mn Fe Co Ni Cu Zn 价电子构型 3d14s2 3d24s1 3d34s2 3d54s1 3d64s2 3d104s2 3d74s2 3d84s2 3d104s1 3d104s2 氧 化 数 +3 +2 +3 +4 +2 +3 +4 +5 +2 +3 +4 +6 +2 +3 +4 +5 +6 +7 +2 +3 +6 +2 +3 +2 +3 +4 +2 +1 +2 (下划线表示常见的氧化态) 过渡元素的原子半径100150...