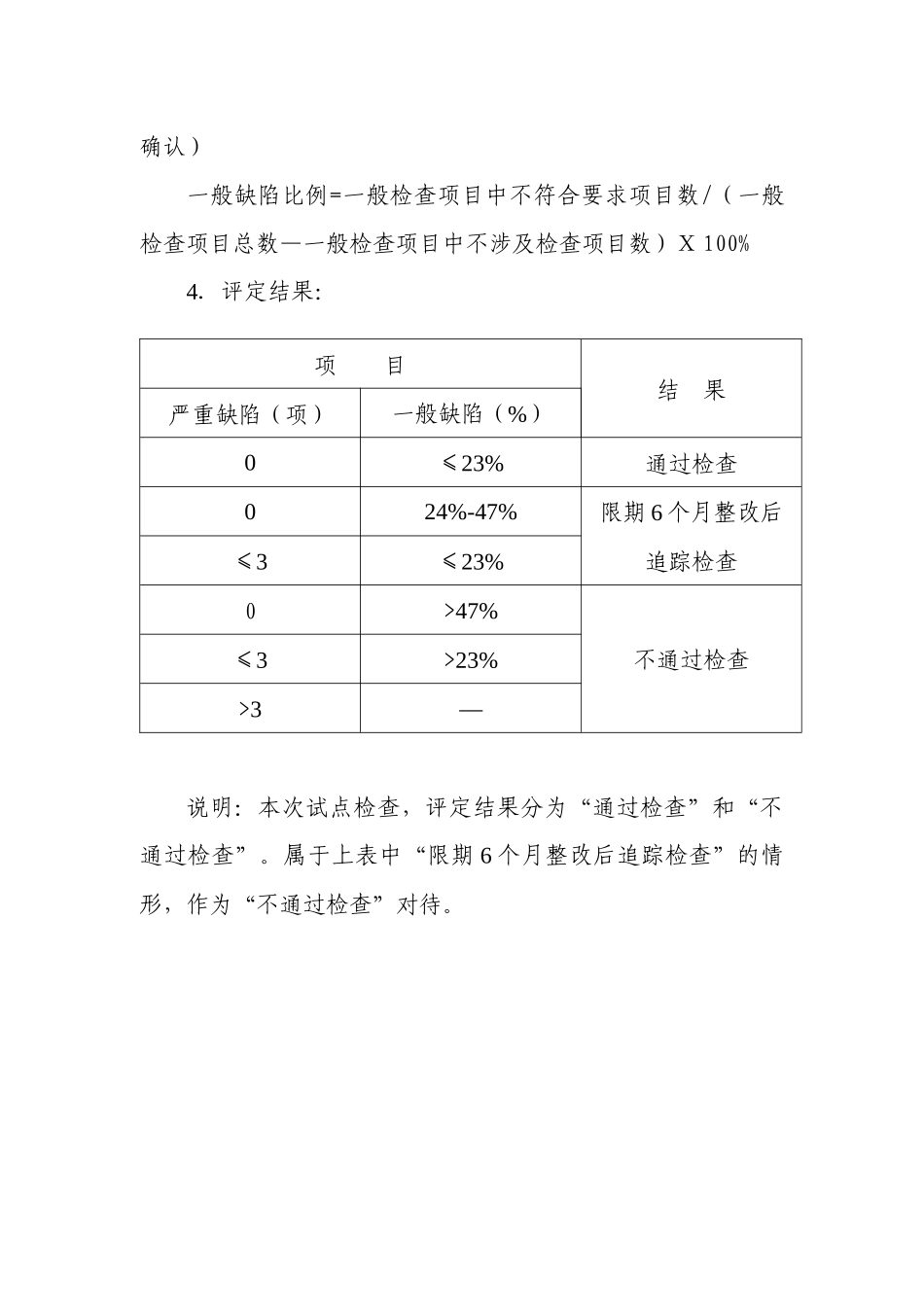
附件 5:医疗器械生产企业质量管理体系法律规范植入性医疗器械检查指南(试点用) 根据《医疗器械生产企业质量管理体系法律规范》和《医疗器械生产企业质量管理体系法律规范植入性医疗器械实施细则》的要求,为了法律规范对植入性医疗器械生产企业的质量管理体系现场检查工作,严格审查程序和要求,统一检查标准,制定本检查指南。一、检查评定方法1.植入性医疗器械生产企业质量管理体系法律规范检查,须根据申请检查的范围,根据植入性医疗器械实施细则,确定相应的检查范围和内容。2.植入性医疗器械检查项目共 313 项,其中重点检查项目(条款前加“*”)40 项,一般检查项目 273 项。3.现场检查时,应对所列项目及其涵盖的内容进行全面检查,并对不符合事实做出描述,如实记录。其中:严重缺陷:是指重点检查项目不符合要求。一般缺陷:是指一般检查项目不符合要求。不涉及检查项目:是指由于产品生产的要求和特点而出现的不涉及检查的项目。(该项目企业应说明理由,检查组予以确认)一般缺陷比例=一般检查项目中不符合要求项目数/(一般检查项目总数—一般检查项目中不涉及检查项目数)Ⅹ 100%4.评定结果:项 目结 果严重缺陷(项)一般缺陷(%)0≤23%通过检查024%-47%限期 6 个月整改后追踪检查≤3≤23%0>47%不通过检查≤3>23%>3—说明:本次试点检查,评定结果分为“通过检查”和“不通过检查”。属于上表中“限期 6 个月整改后追踪检查”的情形,作为“不通过检查”对待。二、检查项目条款检 查 内 容0401是否建立了与企业方针相适应的质量管理机构。0402是否用文件的形式明确规定了质量管理机构各职能部门和人员的职责和权限,以及相互沟通的关系。*0403生产管理部门和质量管理部门负责人是否没有互相兼任。*0404质量管理部门是否具有独立性,是否能独立行使保持企业质量管理体系正常运行和保证产品质量符合性的职能。0501企业负责人是否制定了质量方针,方针是否表明了在质量方面全部的意图和方向并形成了文件,结合 2603 检查进行评价。0502企业负责人是否制定了质量目标,在产品形成的各个层次上进行了分解,质量目标是否可测量,可评估的。是否把目标转换成精确的方法和程序,结合 2604检查进行评价。0503是否配备了与企业方针和质量方针、质量目标相适应,能满足质量管理体系运行和生产管理的需要的人力资源、基础设施和工作环境。检查企业所配备资源符合要求的记录。0504是否制定了进行管理评审的程序文件,...