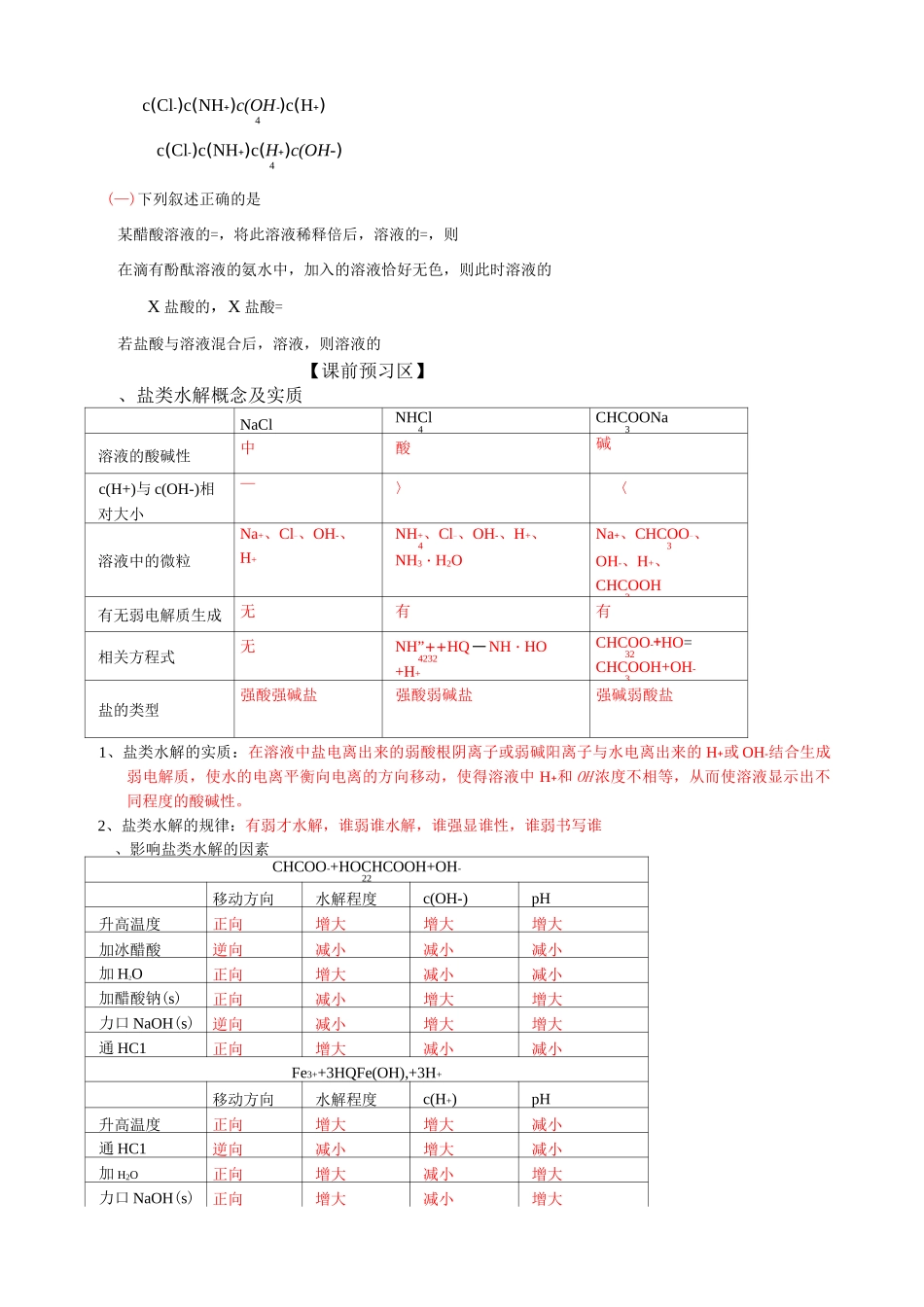
盐类的水解【考纲要求】了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。【教学重点及难点】(1) 盐类水解对水的电离程度的影响的定性、定量的判断。(2) 水解平衡移动用于某些溶液加热后产物的判断。(3) 离子浓度大小比较(4) 盐类水解应用【学习目标】1、能写出水解方程式,说出影响盐类水解的因素;会用水平解平衡原理回答与水解有关的简答题2、知道混合溶液离子浓度大小比较的方法且会写出三个守恒关系式。3、能利用水解原理除杂、能分析盐类蒸干的产物【高考链接】(06-13)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其 pH=1,c(A13+)=04mol•L-i,c(SO42-)=08mol・L-i,则 c(K+)为A015mol•L-1B02mol•L-1C03mol•L-1D04mol•L-1(07—7)室温时,下列混合溶液的 pH 一定小于 7 的是A. pH=3 的盐酸和 pH=11 的氨水等何种混合B. pH=3 的盐酸和 pH=11 的氢氧化钡溶液等体积混合C. pH=3 的醋酸和 pH=11 的氢氧化钡溶液等体积混合D. pH=3 的硫酸和 pH=11 的的氨水等体积混合(08—12)已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为 0.1mol/L 的 NaA 和 NaB 混合溶液中,下列排序正确的是A. c(OH)>c(HA)>c(HB)>c(H+)B. c(OH-)>c(A-)>c(B-)>c(H+)C. c(OH-)>c(B-)>c(A-)>c(H+)D. c(OH-)>c(HB)>c(HA)>c(H+)(—)用厶 1的盐酸滴定厶 1的氨水,滴定过程中不可能出现的结果是c(NH+)c(Cl-)c(OH-)c(H+)4c(NH+)c(Cl-)c(OH-)c(H+)4c(Cl-)c(NH+)c(OH-)c(H+)4c(Cl-)c(NH+)c(H+)c(OH-)4(—)下列叙述正确的是某醋酸溶液的=,将此溶液稀释倍后,溶液的=,则在滴有酚酞溶液的氨水中,加入的溶液恰好无色,则此时溶液的X 盐酸的,X 盐酸=若盐酸与溶液混合后,溶液,则溶液的【课前预习区】、盐类水解概念及实质NaClNHCl4CHCOONa3溶液的酸碱性中酸碱c(H+)与 c(OH-)相对大小—〉〈溶液中的微粒Na+、Cl-、OH-、H+NH+、Cl-、OH-、H+、4NH3・H2ONa+、CHCOO-、3OH-、H+、CHCOOH3有无弱电解质生成无有有相关方程式无NH”++HQ 一 NH・HO4232+H+CHCOO-+HO=32CHCOOH+OH-3盐的类型强酸强碱盐强酸弱碱盐强碱弱酸盐1、盐类水解的实质:在溶液中盐电离出来的弱酸根阴离子或弱碱阳离子与水电离出来的 H+或 OH-结合生成弱电解质,使水的电离平衡向电离的方向移动,使得溶液中 H+和 OH 浓度不相等,从而使溶液显示出不同程度的酸碱性。2、盐类水解的规律:有弱才水解,谁弱谁水解,谁强显谁性,谁弱书写谁、影响盐类水解...