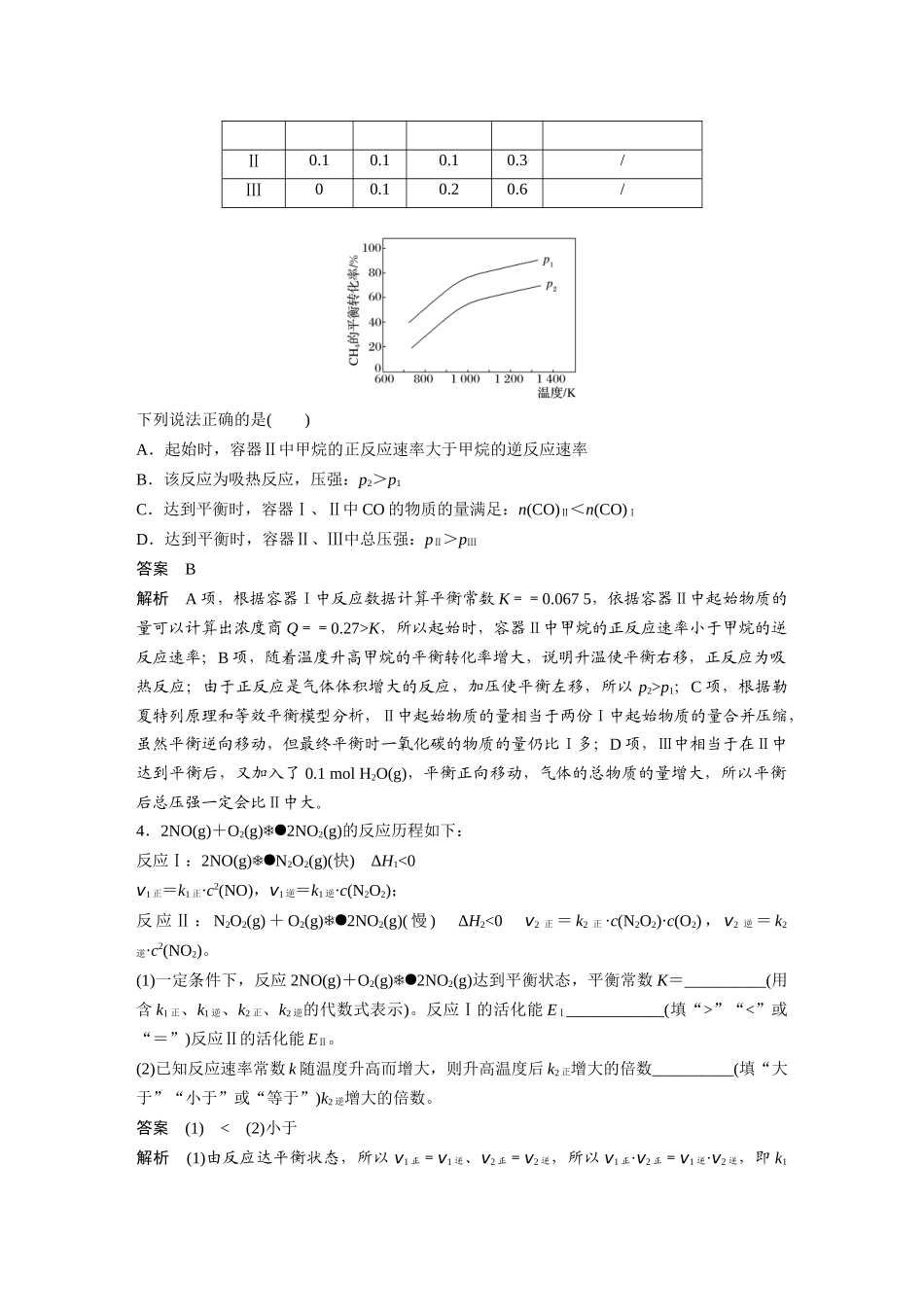
专项提能特训 15 多平衡体系的综合分析1.CO 常用于工业冶炼金属。在不同温度下 CO 还原四种金属氧化物达平衡后气体中 lg 与温度(t)的关系曲线如图。下列说法正确的是( )A.通过增高反应炉的高度,延长矿石和 CO 接触的时间,能减少尾气中 CO 的含量B.CO 不适宜用于工业冶炼金属 CrC.CO 还原 PbO2的反应 ΔH>0D.工业冶炼金属 Cu 时,高温有利于提高 CO 的转化率答案 B解析 A 项,增高反应炉的高度,增大 CO 与铁矿石的接触时间,不能影响平衡移动,CO的利用率不变,错误;B 项,由图像可知用 CO 冶炼金属铬时,lg 一直很大,说明 CO 转化率很低,不适宜,正确;C 项,由图像可知 CO 还原 PbO2的温度越高 lg 越大,说明 CO 转化率越低,平衡逆向移动,故 ΔH<0,错误;D 项,由图像可知用 CO 冶炼金属铜时,温度越高 lg 越大,故 CO 转化率越低,错误。2 . 将 1 mol N2O5 置 于 2 L 密 闭 容 器 中 , 在 一 定 温 度 下 发 生 下 列 反 应 :① 2N2O5(g)2N2O4(g)+O2(g);② N2O4(g)2NO2(g)。达到平衡时,c(O2)=0.2 mol·L -1,c(NO2)=0.6 mol·L-1,则此温度下反应①的平衡常数为( )A.3.2 B.0.2 C. D.答案 B解析 N2O5分解得到 N2O4部分转化为 NO2(g),平衡时 c(O2)=0.2 mol·L-1,c(NO2)=0.6 mol·L-1,则平衡时 c(N2O4)=2c(O2)-c(NO2)=0.2 mol·L-1×2-×0.6 mol·L-1=0.1 mol·L-1,平衡时 c(N2O5)=-2c(O2)=0.5 mol·L-1-0.2 mol·L-1×2=0.1 mol·L-1,故反应①的平衡常数 K===0.2。3.(2024·原创)甲烷制取氢气的反应方程式为 CH4(g)+H2O(g)CO(g)+3H2(g),在三个容积均为 1 L 的恒温恒容密闭容器中,按表中起始数据投料(忽略副反应)。甲烷的平衡转化率与温度、压强的关系如下图所示。容器起始物质的量/molCH4的平衡转化率CH4H2OCOH2Ⅰ0.10.10050%Ⅱ0.10.10.10.3/Ⅲ00.10.20.6/下列说法正确的是( )A.起始时,容器Ⅱ中甲烷的正反应速率大于甲烷的逆反应速率B.该反应为吸热反应,压强:p2>p1C.达到平衡时,容器Ⅰ、Ⅱ中 CO 的物质的量满足:n(CO)Ⅱ<n(CO)ⅠD.达到平衡时,容器Ⅱ、Ⅲ中总压强:pⅡ>pⅢ答案 B解析 A 项,根据容器Ⅰ中反应数据计算平衡常数 K==0.067 5,依据容器Ⅱ中起始物质的量可以计算出浓度商 Q==0.27>K,所以起始时,容器Ⅱ中甲烷的正反应...