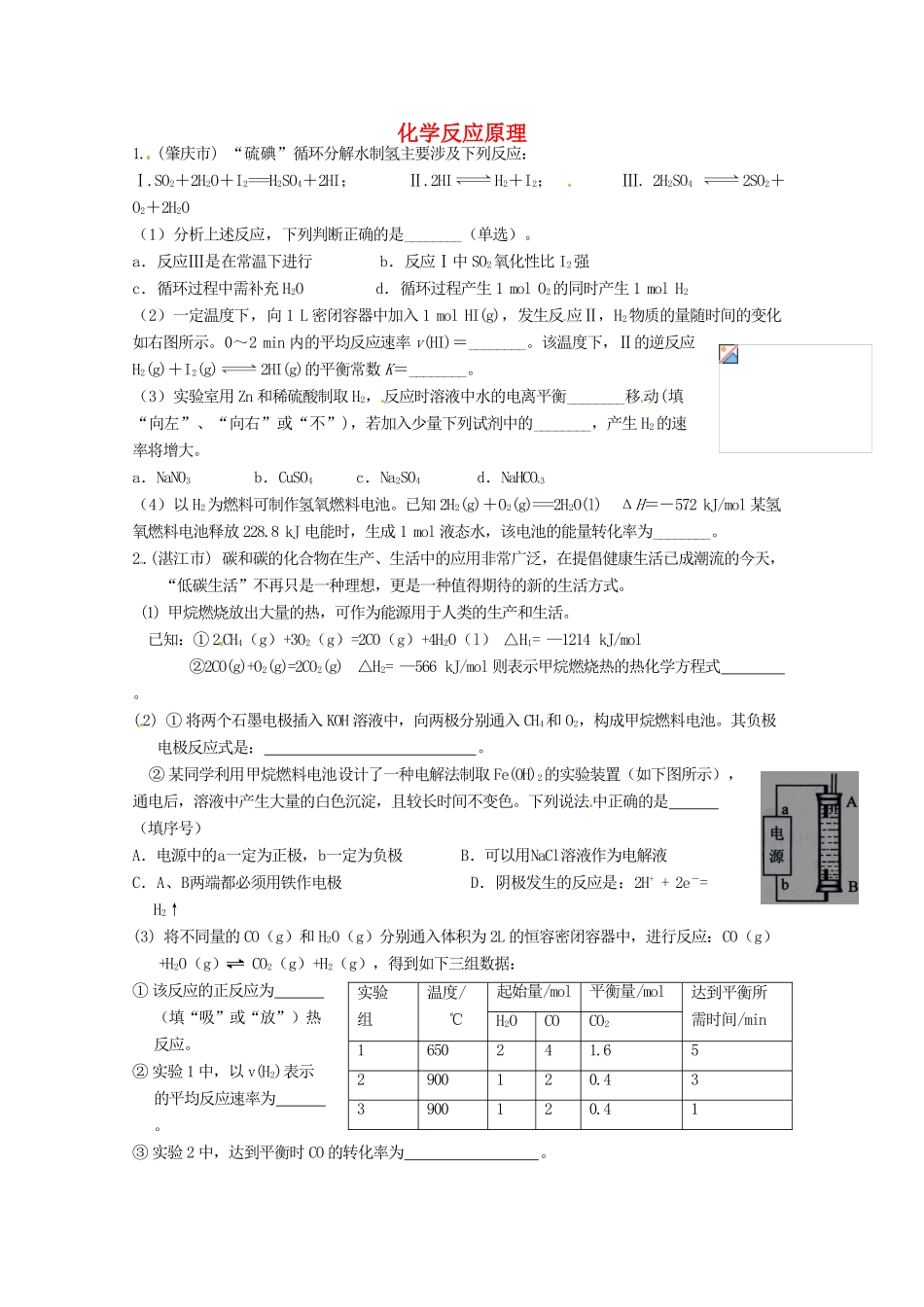
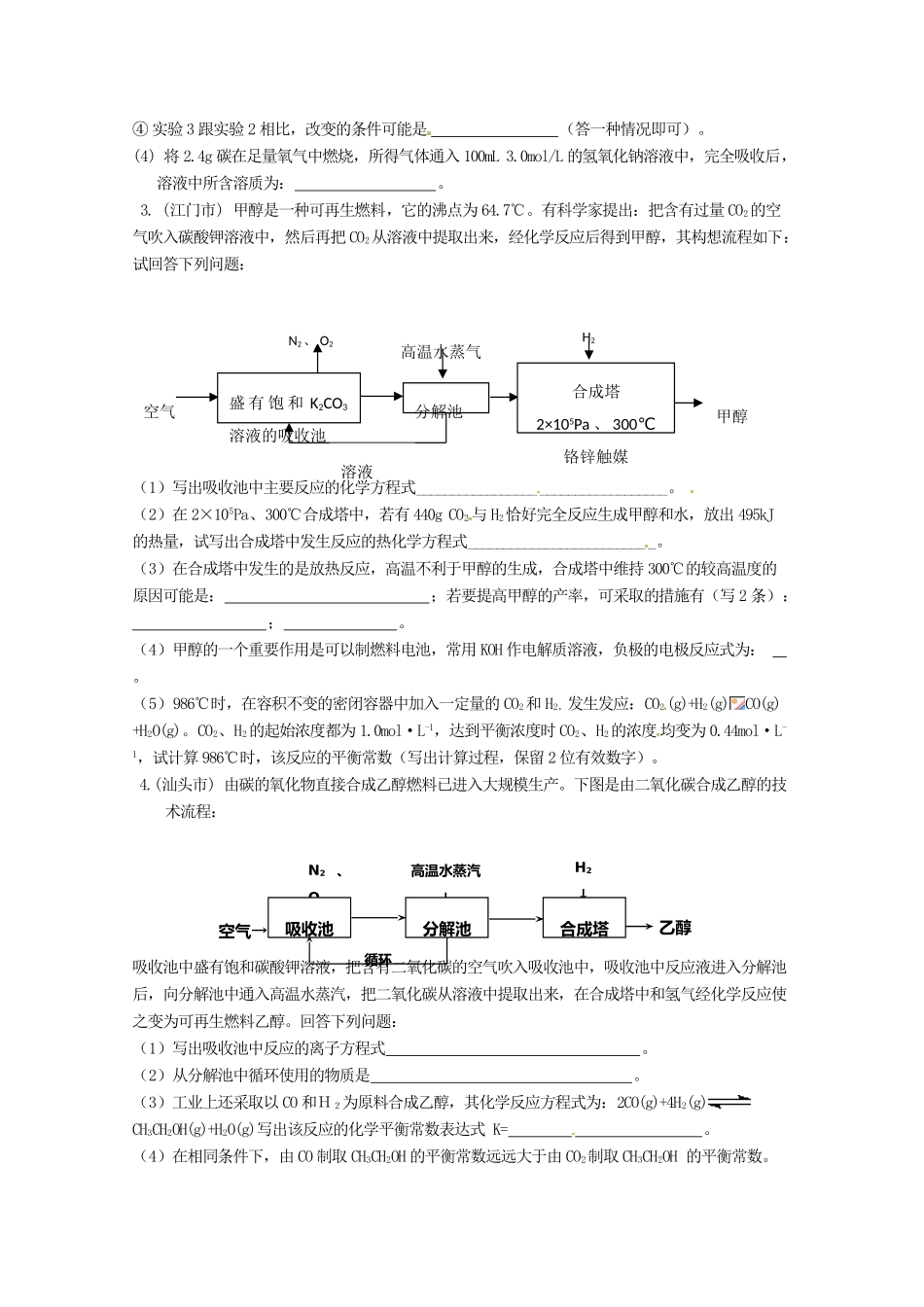
化学反应原理1. (肇庆市) “硫碘”循环分解水制氢主要涉及下列反应:Ⅰ.SO2+2H2O+I2===H2SO4+2HI; Ⅱ.2HIH2+I2; Ⅲ. 2H2SO4 2SO2+O2+2H2O(1)分析上述反应,下列判断正确的是________(单选)。a.反应Ⅲ是在常温下进行 b.反应Ⅰ中 SO2氧化性比 I2强 c.循环过程中需补充 H2O d.循环过程产生 1 mol O2的同时产生 1 mol H2(2)一定温度下,向 1 L 密闭容器中加入 1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如右图所示。0~2 min 内的平均反应速率 v(HI)=________。该温度下,Ⅱ的逆反应 H2(g)+I2(g)2HI(g)的平衡常数 K=________。(3)实验室用 Zn 和稀硫酸制取 H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”),若加入少量下列试剂中的________,产生 H2的速率将增大。a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHCO 3(4)以 H2为燃料可制作氢氧燃料电池。已知 2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ/mol 某氢氧燃料电池释放 228.8 kJ 电能时,生成 1 mol 液态水,该电池的能量转化率为________。2.(湛江市) 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。(1) 甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。 已知:① 2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= —1214 kJ/mol②2CO(g)+O2(g)=2CO2(g) △H2= —566 kJ/mol 则表示甲烷燃烧热的热化学方程式 。(2) ① 将两个石墨电极插入 KOH 溶液中,向两极分别通入 CH4和 O2,构成甲烷燃料电池。其负极电极反应式是: 。② 某同学利用甲烷燃料电池设计了一种电解法制取 Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)A.电源中的a一定为正极,b一定为负极 B.可以用NaCl溶液作为电解液C.A、B两端都必须用铁作电极 D.阴极发生的反应是:2H+ + 2e-= H2↑(3) 将不同量的 CO(g)和 H2O(g)分别通入体积为 2L 的恒容密闭容器中,进行反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:① 该反应的正反应为 (填“吸”或“放”)热反应。② 实验 1 中,以 v(H2)表示的平均反应速率为 。③ 实验 2 中,达到平衡时 CO 的转化率为 。实验组 温度/℃起始量/mo...