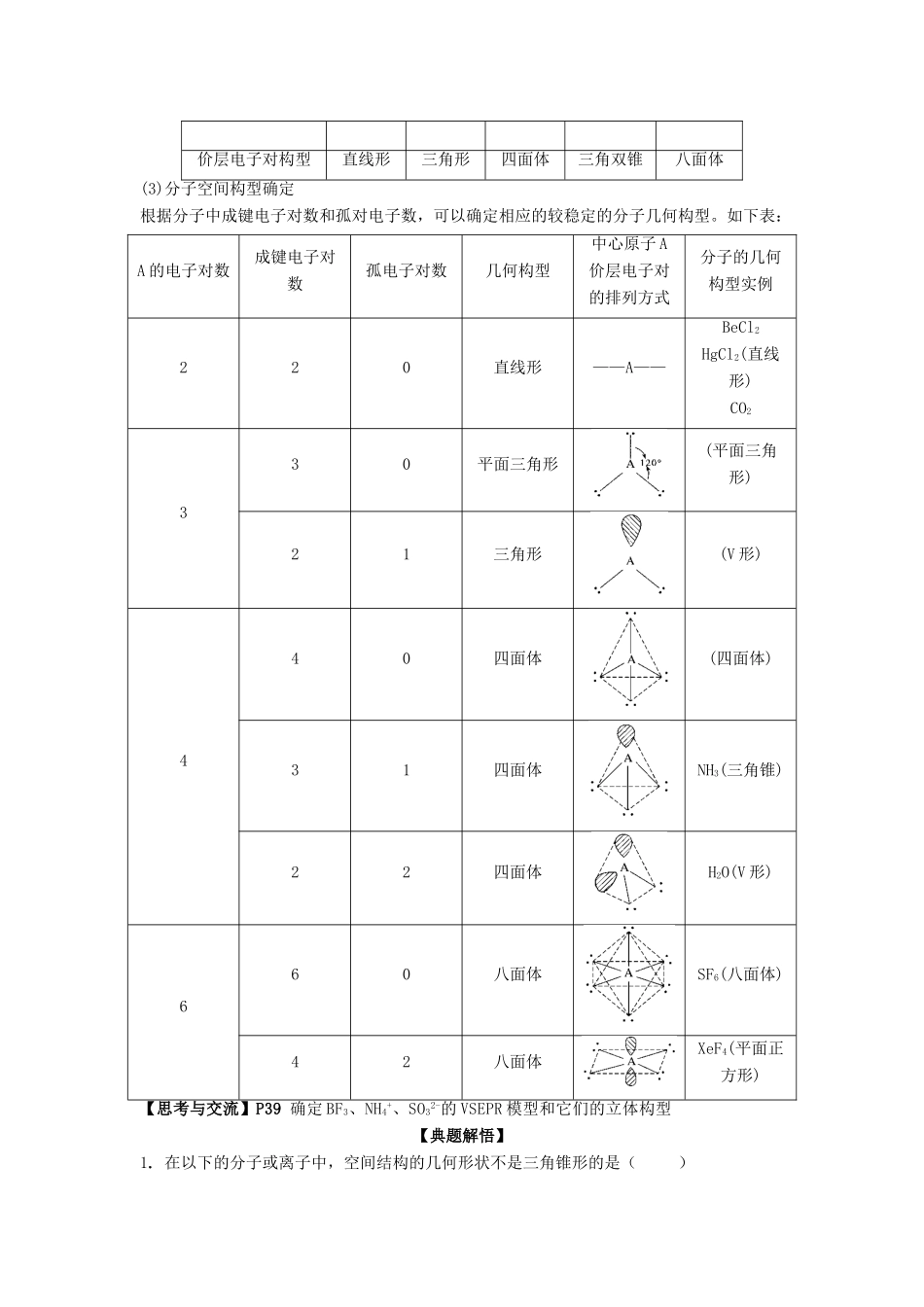
《选修三第二章第二节 分子的立体构型》导学案(第 1 课时)学习时间 2011 — 2012 学年上学期 周【课标要求】知识与技能要求:1、认识共价分子的多样性和复杂性 2、初步认识价层电子对互斥模型 3、能用 VSEPR 模型预测简单分子或离子的立体结构【课前预习】1.化学式: 2.结构式: 3.结构简式: 4.电子式: 5.价电子: 【知识整理】运用你对分子的已有的认识,完成下列表格,写出 C、H、N、O 的电子式,根据共价键的饱和性讨论 C、H、N、O 的成键情况。【归纳】原子不同,可形成的电子对数目不同,共价键的饱和性不同。【阅读思考】阅读教材 P35-36,先完成下表,然后思考所给问题写出 CO2、H2O、NH3、CH2O、CH4的电子式和结构式;根据电子式、结构式描述CO2、H2O、NH3、CH2O、CH4的成键情况.分析分子内的原子总数、孤对电子数及空间结构。分子CO2H2ONH3CH2OCH4C2H4电子式结构式原子总数孤对电子数空间结构直线型V 型三角锥形平面三角形正四面体1.分子结构多样性的原因?2.什么是分子的空间结构?结构式能反映出分子的空间构造吗?3.同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?同为四原子分子,CH2O 与 NH3 分子的的空间结构也不同,什么原因?【阅读】 P37 科学视野,思考:分子的空间结构我们看不见,那么科学家是怎样测定的呢?【思考与交流】P381.以 S 和 P 为例,说明如何根据主族元素在周期表中的位置确定它的价电子数?2.以 N 和 Cl 为例,说明如何根据主族元素在周期表中的位置确定它最多能接受的电子数?原子HCNO电子式可形成共用电子对数1432成键情况1432【问题】如何计算中心原子上的孤电子对数?(P37)如何计算价电子对数?二者的主要作用是什么?【典例解悟】下列叙述正确的是( )A.NH3是极性分子,分子中 N 原子处在 3 个 H 原子所组成的三角形的中心B.CCl4是非极性分子,分子中 C 原子处在 4 个 Cl 原子所组成的正方形的中心C.H2O 是极性分子,分子中 O 原子不处在 2 个 H 原子所连成的直线的中央D.CO2是非极性分子,分子中 C 原子不处在 2 个 O 原子所连成的直线的中央【阅读与思考】阅读教材 P38-39,尝试用“价层电子对互斥模型理论”判断常见分子的立体结构型。【方法小结】1.理论模型:分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。2.价电子对之间...