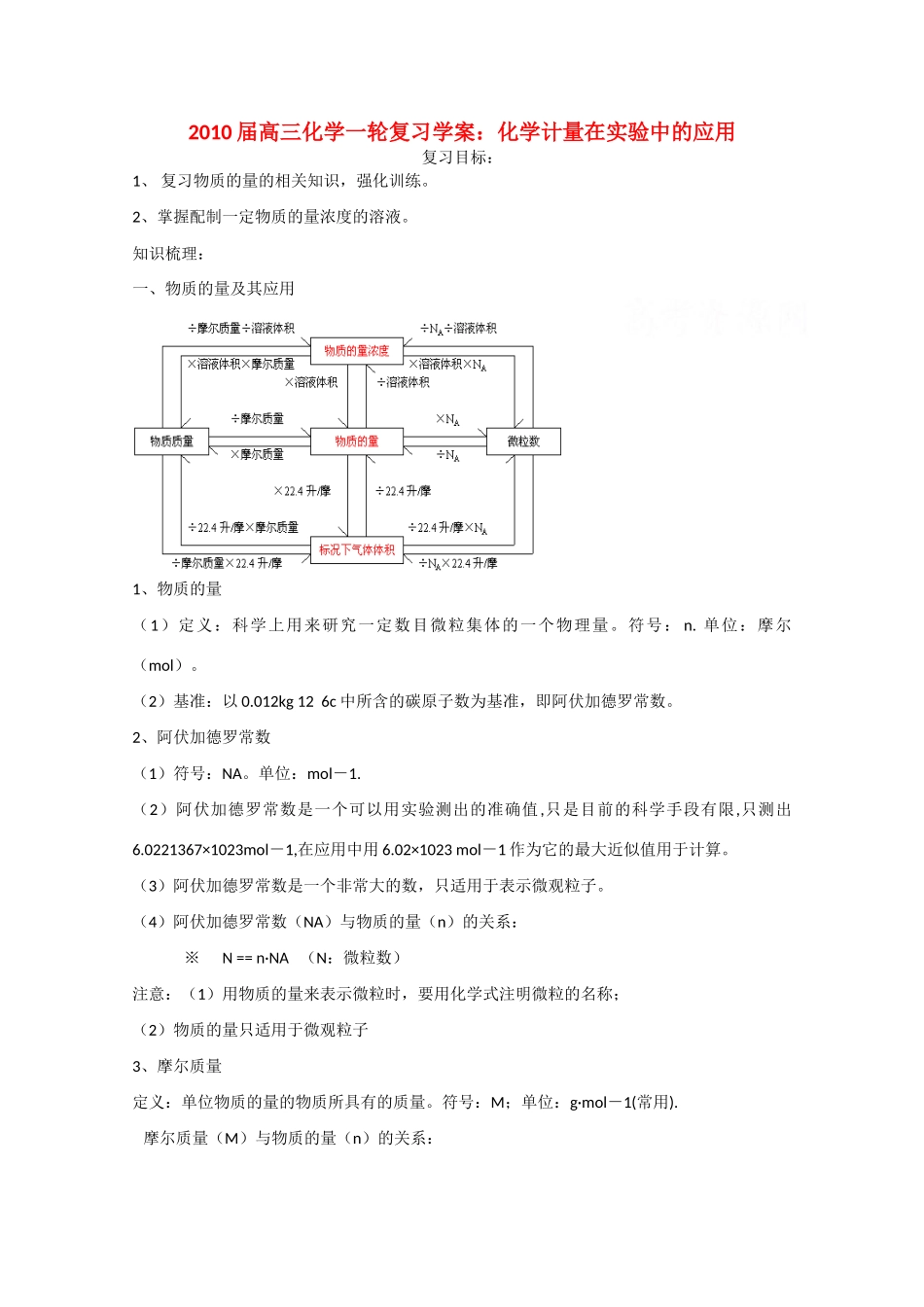
2010 届高三化学一轮复习学案:化学计量在实验中的应用复习目标:1、 复习物质的量的相关知识,强化训练。2、掌握配制一定物质的量浓度的溶液。知识梳理:一、物质的量及其应用1、物质的量(1)定义:科学上用来研究一定数目微粒集体的一个物理量。符号: n. 单位:摩尔(mol)。(2)基准:以 0.012kg 12 6c 中所含的碳原子数为基准,即阿伏加德罗常数。2、阿伏加德罗常数(1)符号:NA。单位:mol-1.(2)阿伏加德罗常数是一个可以用实验测出的准确值,只是目前的科学手段有限,只测出6.0221367×1023mol-1,在应用中用 6.02×1023 mol-1 作为它的最大近似值用于计算。(3)阿伏加德罗常数是一个非常大的数,只适用于表示微观粒子。(4)阿伏加德罗常数(NA)与物质的量(n)的关系: ※ N == n·NA (N:微粒数)注意:(1)用物质的量来表示微粒时,要用化学式注明微粒的名称;(2)物质的量只适用于微观粒子3、摩尔质量定义:单位物质的量的物质所具有的质量。符号:M;单位:g·mol-1(常用). 摩尔质量(M)与物质的量(n)的关系: ※ m == n·M (m :物质的质量)4、气体摩尔体积:① 定义:一定温度和压强下,单位物质的量的任何气体所占的体积。符号:Vm,单位:L/mol.② 标况下,1mol 任何气体的体积都约为 22.4L.即标况下,Vm=22.4 L/mol.③ 计算公式:标况下,n=V/(22.4 L/mol).④ 气体摩尔质量的几种计算方法:a M=m/n; b 标况下,M=22.4×d (d 是气体的密度,单位是 g/L)c 相对密度 D=M1/M2 (M1 是未知气体的摩尔质量,M2 是已知气体的摩尔质量)5、阿伏加德罗定律及推论① 定义:在同温同压下,同体积的任何气体都含有相同数目的分子,这就是阿伏加德罗定律。② 阿伏加德罗定律的应用同温同压下,任何气体的体积比等于气体的物质的量之比,即 V1/V2 == n1/n2同温、定容时,任何气体的压强比等于气体的物质的量之比,即 P1/P2 == n1/n2同温同压下,任何气体的密度比等于它们的相对分子质量之比,即 ρ1/ρ2== M1/M2同温同压下,任何气体的质量比等于它们的相对分子质量之倒数比,即 m1/m2=M1/M2同温、同压下,等质量的任何气体的体积比等于等于它们的相对分子质量之倒数比: V1/V2=M2/M16、物质的量浓度(1)定义:单位体积溶液中所含溶质的物质的量来表示的浓度.符号:CB,单位:mol/L.计算公式: C=n/v.(2)常见的几种计算类型:A、气体溶于水求所得溶液浓度例:在标况下,1 体积水中溶解 500 ...