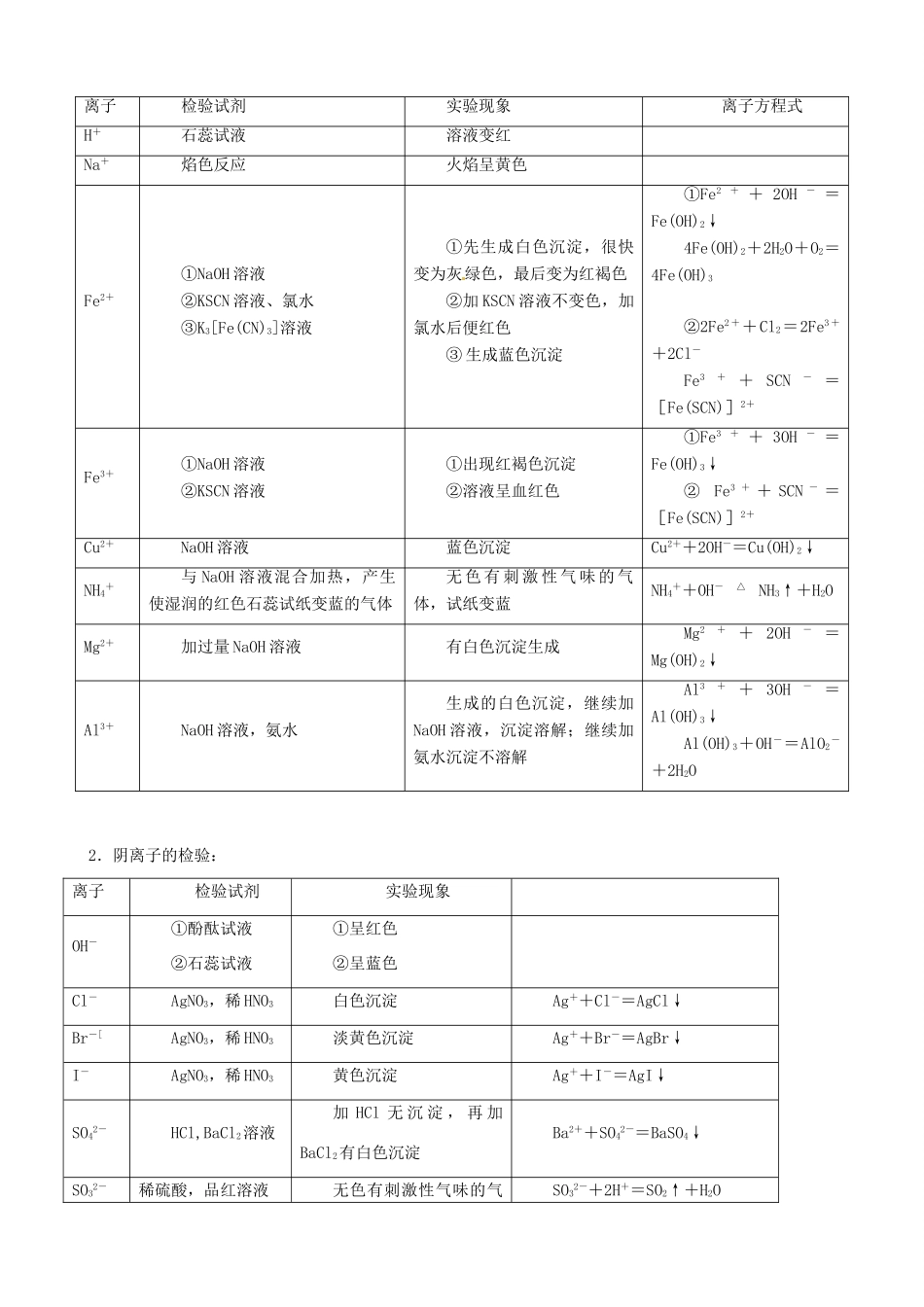
第二节 物质的检验、分离和提纯【高考目标定位】考纲导引考点梳理1. 掌握化学实验基本方法和技能。2. 能对常见的物质进行检验、分离和提纯。1. 常见物质的检验。2. 物质的分离和提纯。【考纲知识梳理】一、物质的检验在中学化学教材中,物质的检验通常有鉴定、鉴别和推断三类。其共同点是:均需根据物质的特征反应,选择适当的试剂和操作,通过反应中出现的不同现象(如:沉淀的生成和溶解、气体的逸出和气味、颜色的变化等)加以判定,必要时须写出有关反应的离子方程式或化学方程式。它们的区别在于:鉴定通常是指对于一种物质的定性检验,必须根据物质的化学特性,分别检出阴、阳离子;鉴别通常是指对两种或两种以上的物质进行定性辨认,可根据一种物质的特性或特征反应来区别于另一种,也可根据几种物质的气味、状态、颜色、溶解性或溶解时的热效应等一般性质的不同加以区别;推断是通过已知实验事实,根据性质分析推理出被检物质的名称或组成。物质检验的方法常用的物理方法有:①观察法;②嗅试法;③加热法;④水溶法;⑤焰色反应法等。常用的化学方法有:①加热法;②点燃法;③指示剂法;④显色法(如无水硫酸铜遇水显蓝色);⑤互滴法;⑥不同试剂两两混合法(又称:简明列表法)等。1.阳离子的检验:2.阴离子的检验:离子检验试剂实验现象OH-①酚酞试液②石蕊试液①呈红色②呈蓝色Cl-AgNO3,稀 HNO3白色沉淀Ag++Cl-=AgCl↓Br-[AgNO3,稀 HNO3淡黄色沉淀Ag++Br-=AgBr↓I-AgNO3,稀 HNO3黄色沉淀Ag++I-=AgI↓SO42-HCl,BaCl2溶液加 HCl 无 沉 淀 , 再 加BaCl2有白色沉淀Ba2++SO42-=BaSO4↓SO32-稀硫酸,品红溶液无色有刺激性气味的气SO32-+2H+=SO2↑+H2O离子检验试剂实验现象离子方程式H+石蕊试液溶液变红Na+焰色反应火焰呈黄色Fe2+①NaOH 溶液②KSCN 溶液、氯水③K3[Fe(CN)3]溶液①先生成白色沉淀,很快变为灰绿色,最后变为红褐色②加 KSCN 溶液不变色,加氯水后便红色③ 生成蓝色沉淀①Fe2+ + 2OH- =Fe(OH)2↓4Fe(OH)2+2H2O+O2=4Fe(OH)3②2Fe2 ++Cl2=2Fe3 ++2Cl-Fe3+ + SCN- =[Fe(SCN)]2+Fe3+①NaOH 溶液②KSCN 溶液①出现红褐色沉淀②溶液呈血红色①Fe3+ + 3OH- =Fe(OH)3↓② Fe3 + + SCN - =[Fe(SCN)]2+Cu2+NaOH 溶液蓝色沉淀Cu2++2OH-=Cu(OH)2↓NH4+与 NaOH 溶液混合加热,产生使湿润的红色石蕊试纸变蓝的气体无 色 ...