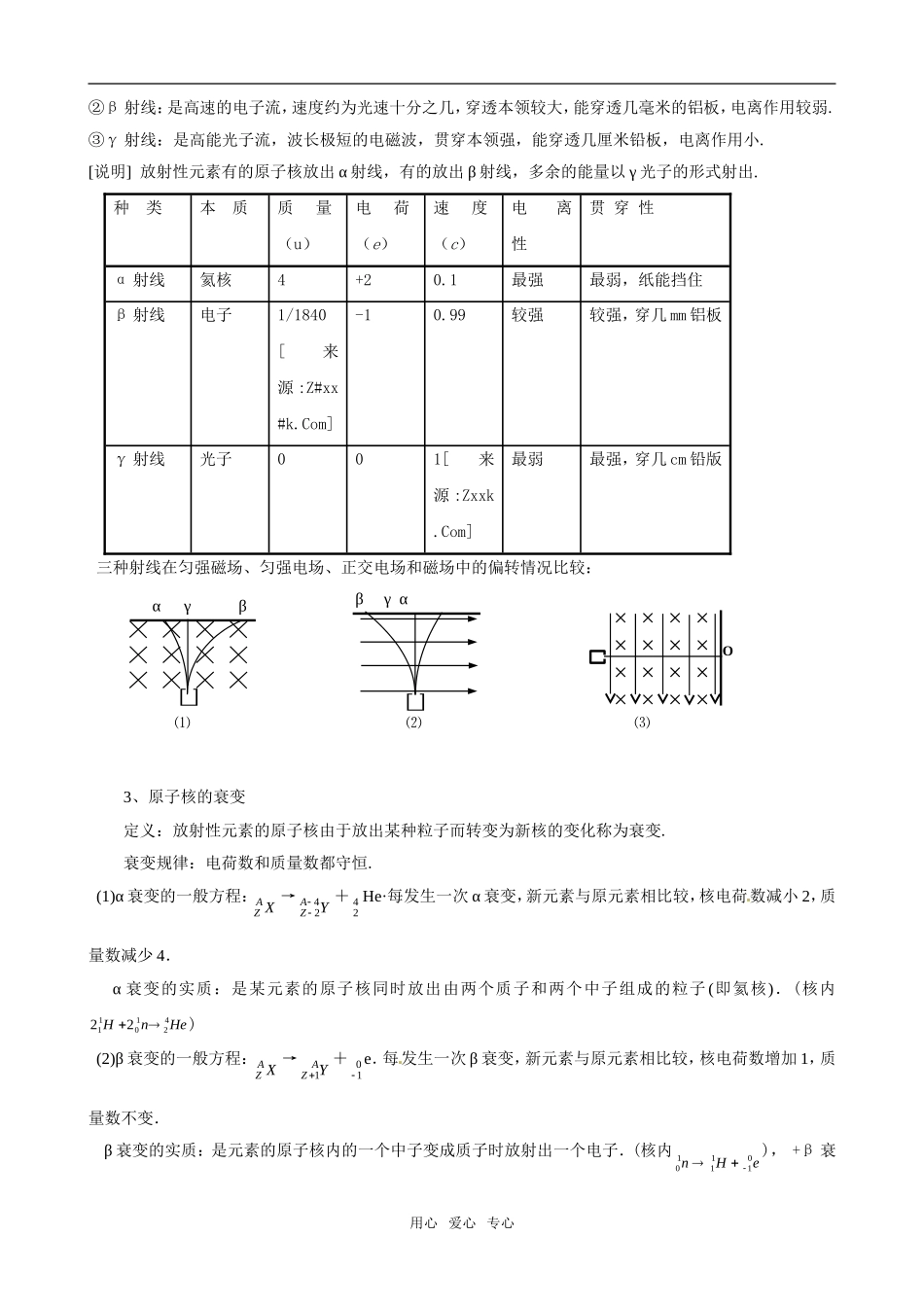
第 2 章 原子 原子核【考纲知识梳理】一、原子的核式结构模型1、汤姆生的“枣糕”模型(1)1897 年汤姆生发现了电子,使人们认识到原子有复杂结构,揭开了研究原子的序幕. (2)“枣糕”模型:原子是一个球体,正电荷均匀分布在整个球内,电子像枣糕里的枣子一样镶嵌在原子里.2、卢瑟福的核式结构模型 1909~1911 年,英国物理学家卢琴福和他的助手们进行了 α 粒子散射实验(1)实验装置如图所示:如图所示,用 α 粒子轰击金箔,由于金原子中的带电微粒对 α粒子有库仓力作用,一些 α 粒子穿过金箔后改变了运动方向,这种现象叫做 α 粒子散射.荧光屏可以沿着图中虚线转动,用来统计向不同方向散射的粒子数目.全部设备装在真空中.(2)α 粒子散射实验结果:绝大多数 α 粒子穿过金箔后基本上仍沿原来的方向前进,但有少数 α 粒子发生了较大的偏转.,极少数偏转角超过 900,有的甚至被弹回,偏转角几乎达到 1800.(3)现象解释:认为原子中的全部正电荷和几乎所有质量都集中到一个很小的核上,由于核很小,大部分 α 粒子穿过金箔时都离核很远,受到的库仑力很小,它们的运动几乎不受影响.只有少数 α 粒子从原子核附近飞过,明显受到原子核的库仑力而发生大角度偏转.核式结构模型:在原子的中心有一个很小的核,叫做原子核,原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外空间里绕着核旋转.原子核所带的单位正电荷数等于核外的电子数,所以整个原子是呈电中性的.电子绕着核旋转所需的向心力就是核对它的库仑引力.[说明] 核式结构模型的实验基础是 α 粒子散射实验,原子核是多么小,原子内部是多么“空”.从 α 粒子散射的实验数据,估计原子核半径的数量级为 10-14m~10-15m,而原子半径的数量级是10-10m.二、天然放射性现象1.放射性现象:贝克勒耳发现天然放射现象,使人们认识到原子核也有复杂结构,揭开了人类研究原子核结构的序幕.通过对天然放射现象的研究,人们发现原子序数大于 83 的所有天然存在的元素都有放射性,原子序数小于 83 的天然存在的元素有些也具有放射性,它们放射出来的射线共有三种:α 射线、β 射线、γ 射线.2、三种射线的本质和特性比较①α 射线:是氦核( 42 He)流,速度约为光速的十分之一,在空气中射程几厘米,贯穿本领小,电离作用强.用心 爱心 专心②β 射线:是高速的电子流,速度约为光速十分之几,穿透本领较大,能穿透几毫米的...