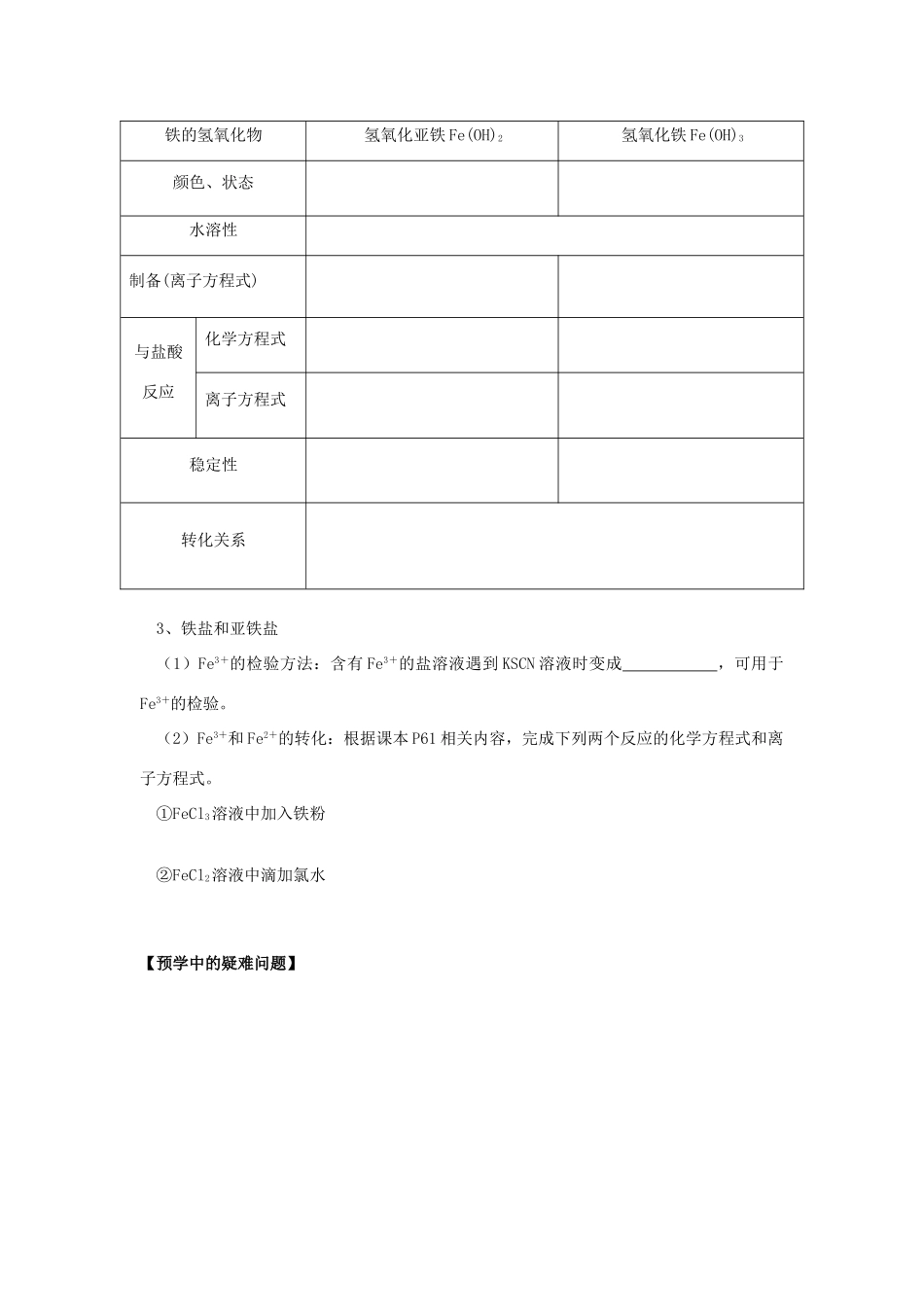
第二节 几种重要的金属化合物(第 3 课时 铁的重要化合物)【明确学习目标】1、了解 FeO、Fe2O3 、Fe3O4的性质和应用。2、掌握 Fe(OH)2 和 Fe(OH)3的制备和性质。(学习重点)3、掌握 Fe2+、Fe3+的检验及相互转化。(学习重点、难点)【相关知识点的回顾】(1)以前我们学习过哪些铁的化合物?其中铁的化合价分别是多少?(2)根据 Fe3+和 Fe2+的化合价判断,Fe3+应只具有___________性,Fe2+应具有___________性和___________性,Fe 应只具有___________性。【预学能掌握的内容】三、铁的重要化合物1、铁的氧化物:阅读课本 P59 相关内容,结合初中所学知识,完成下表。名称氧化亚铁氧化铁四氧化三铁俗名——化学式铁的化合价颜色 状态水溶解性与 H+反应——与 CO 反应稳定性 2、铁的氢氧化物:阅读课本 P60 相关内容,完成下表。铁的氢氧化物氢氧化亚铁 Fe(OH)2氢氧化铁 Fe(OH)3颜色、状态水溶性制备(离子方程式)与盐酸反应化学方程式离子方程式稳定性转化关系3、铁盐和亚铁盐(1)Fe3+的检验方法:含有 Fe3+的盐溶液遇到 KSCN 溶液时变成 ,可用于Fe3+的检验。(2)Fe3+和 Fe2+的转化:根据课本 P61 相关内容,完成下列两个反应的化学方程式和离子方程式。①FeCl3溶液中加入铁粉②FeCl2溶液中滴加氯水【预学中的疑难问题】三、 铁的重要化合物〖交流展示〗小组交流课前预习收获与疑惑,思考如下问题并积极展示。(1)Fe3O4中铁的化合价如何?你能据此尝试写出它与盐酸反应的化学方程式和离子方程式吗?(2)能由 FeO 和 Fe2O3直接加水分别制得 Fe(OH)2 和 Fe(OH)3吗?你能尝试小结金属氧化物与水反应的不同情况吗?〖实验探究 1〗Fe(OH)2、Fe(OH)3的制备完成课本 P60“实验 3-9”,探究、交流如下问题:(1)FeCl3溶液呈 色,FeSO4溶液呈 色。 (2)向 FeCl3溶液滴加 NaOH 溶液,现象为 ,反应的化学方程式为 ,离子方程式为 。(3)向 FeSO4溶液滴加 NaOH 溶液,瞬间现象为 ,反应的化学方程式为 ,离子方程式为 。随后生成的白色沉淀迅速变成灰绿色,最后变成了红褐色的原因是 ,化学方程式为 。 (4)Fe(OH)2 在空气中极易被氧化成 Fe(OH)3,所以为了较长时间看到 FeSO4 溶液和NaOH 溶液反应产生白色沉淀现象,你可以在实验中采取哪些措施? (5)氢氧化亚铁若在空气中加热能否得氧化亚铁,为什么?〖实验探究 2〗铁盐和亚铁盐的检验和转化完成课本 P61“实验 3...