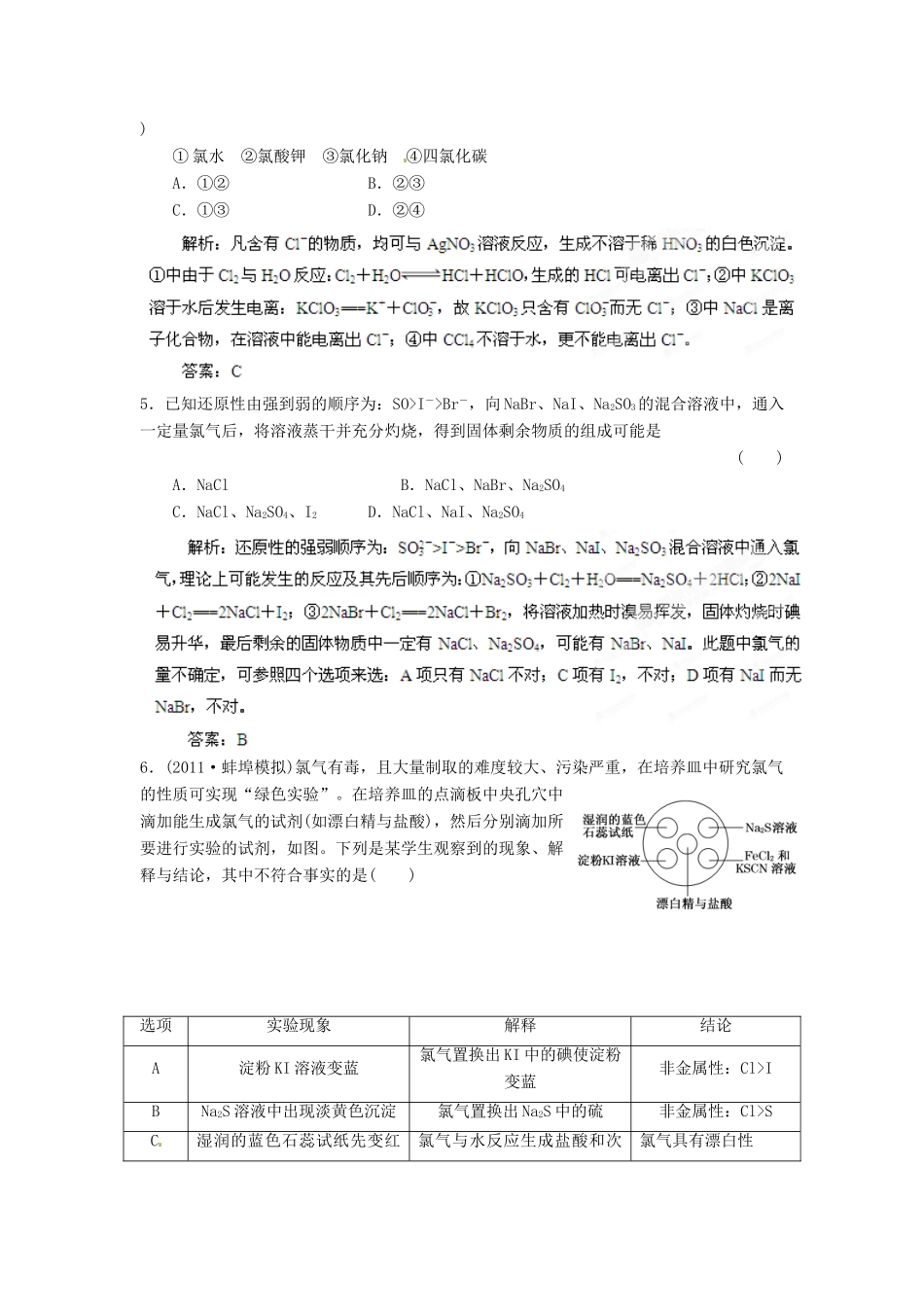
013 届高考化学一轮精品教学案 4.2 富集在海水中的元素—氯一、选择题(本题包括 10 小题,每小题 5 分,共 50 分)1.下列说法正确的是( )① 氯气的性质活泼,它与氢气混合后立即发生爆炸② 实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收③ 新制氯水的氧化性强于久置氯水④ 检验 HCl 气体中是否混有 Cl2方法是将气体通入硝酸银溶液⑤ 除去 HCl 气体中的 Cl2,可将气体通入饱和食盐水A.①②③ B.②③④C.③ D.③⑤2.[双选题]下列有关化学反应过程或实验现象的叙述中,正确的是( )A.氯气的水溶液可以导电,说明氯气是电解质B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气D.在滴有酚酞的 Na2CO3溶液中,加入 BaCl2溶液后溶液的红色褪去,说明 BaCl2溶液具有酸性3.下列离子方程式正确的是( )① 氯气与水反应:Cl2+H2O===2H++Cl-+ClO-② 氯气与氢氧化钠溶液反应:Cl2+2OH-===Cl-+ClO-+H2O③ 浓盐酸与二氧化锰共热:MnO2+4HCl=====Mn2 ++2Cl-+Cl2↑+2H2O④ 漂白粉溶液中通入少量的二氧化碳气体:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClOA.①③ B.②④C.②③ D.①④解析:反应①生成的 HClO 为弱酸,应用 HClO 表示;反应③中浓盐酸可全部电离,应写成 H+和 Cl-的形式。答案:B4.向下列溶液中分别加 AgNO3溶液和稀 HNO3,能生成不溶于稀 HNO3的白色沉淀的是( )① 氯水 ②氯酸钾 ③氯化钠 ④四氯化碳A.①② B.②③C.①③ D.②④5.已知还原性由强到弱的顺序为:SO>I->Br-,向 NaBr、NaI、Na2SO3的混合溶液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )A.NaCl B.NaCl、NaBr、Na2SO4C.NaCl、Na2SO4、I2 D.NaCl、NaI、Na2SO46.(2011·蚌埠模拟)氯气有毒,且大量制取的难度较大、污染严重,在培养皿中研究氯气的性质可实现“绿色实验”。在培养皿的点滴板中央孔穴中滴加能生成氯气的试剂(如漂白精与盐酸),然后分别滴加所要进行实验的试剂,如图。下列是某学生观察到的现象、解释与结论,其中不符合事实的是( )选项实验现象解释结论A淀粉 KI 溶液变蓝氯气置换出 KI 中的碘使淀粉变蓝非金属性:Cl>IBNa2S 溶液中出现淡黄色沉淀氯气置换出 Na2S 中的硫非金属性:Cl>SC湿润的蓝色石蕊试纸先变红...