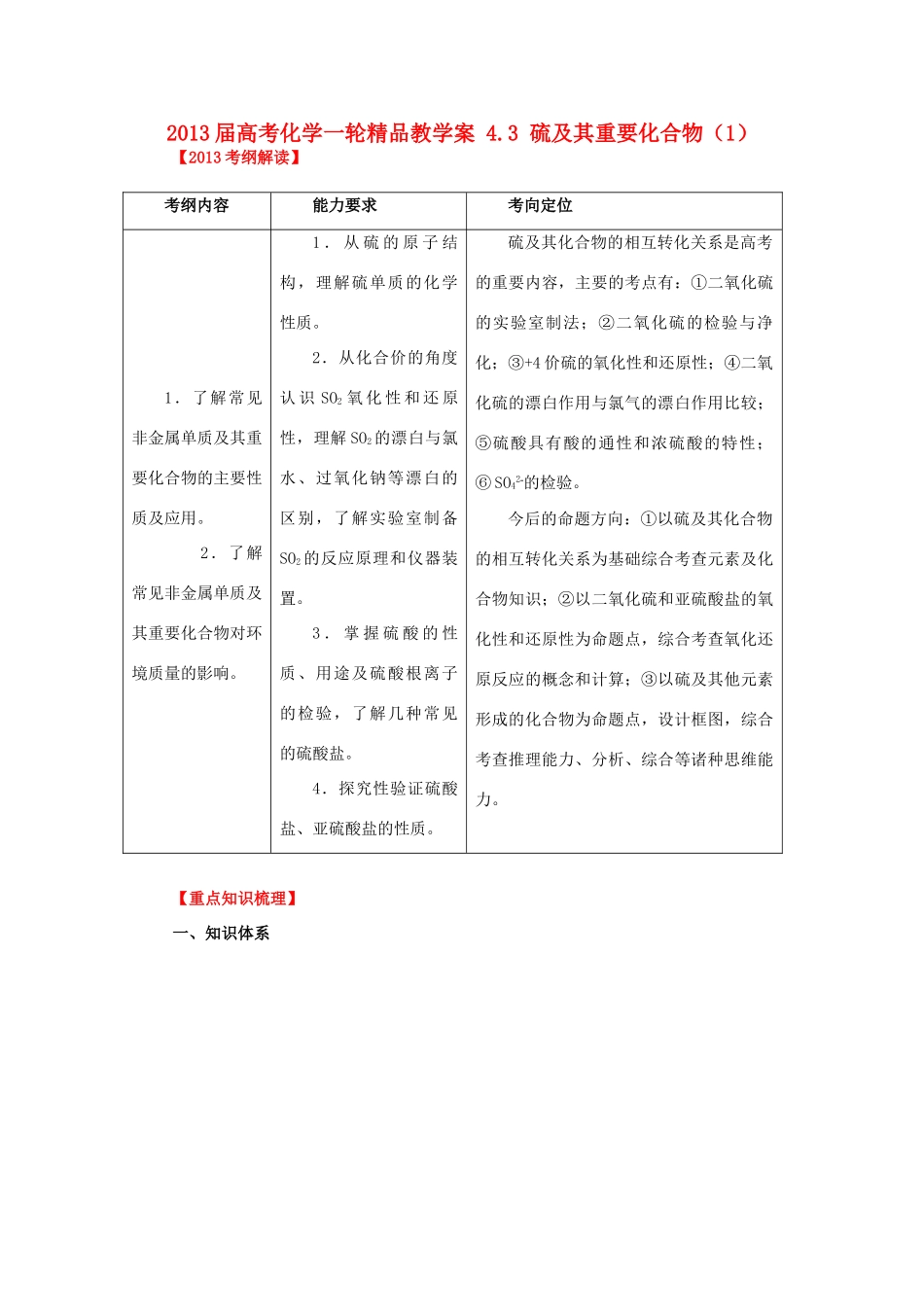
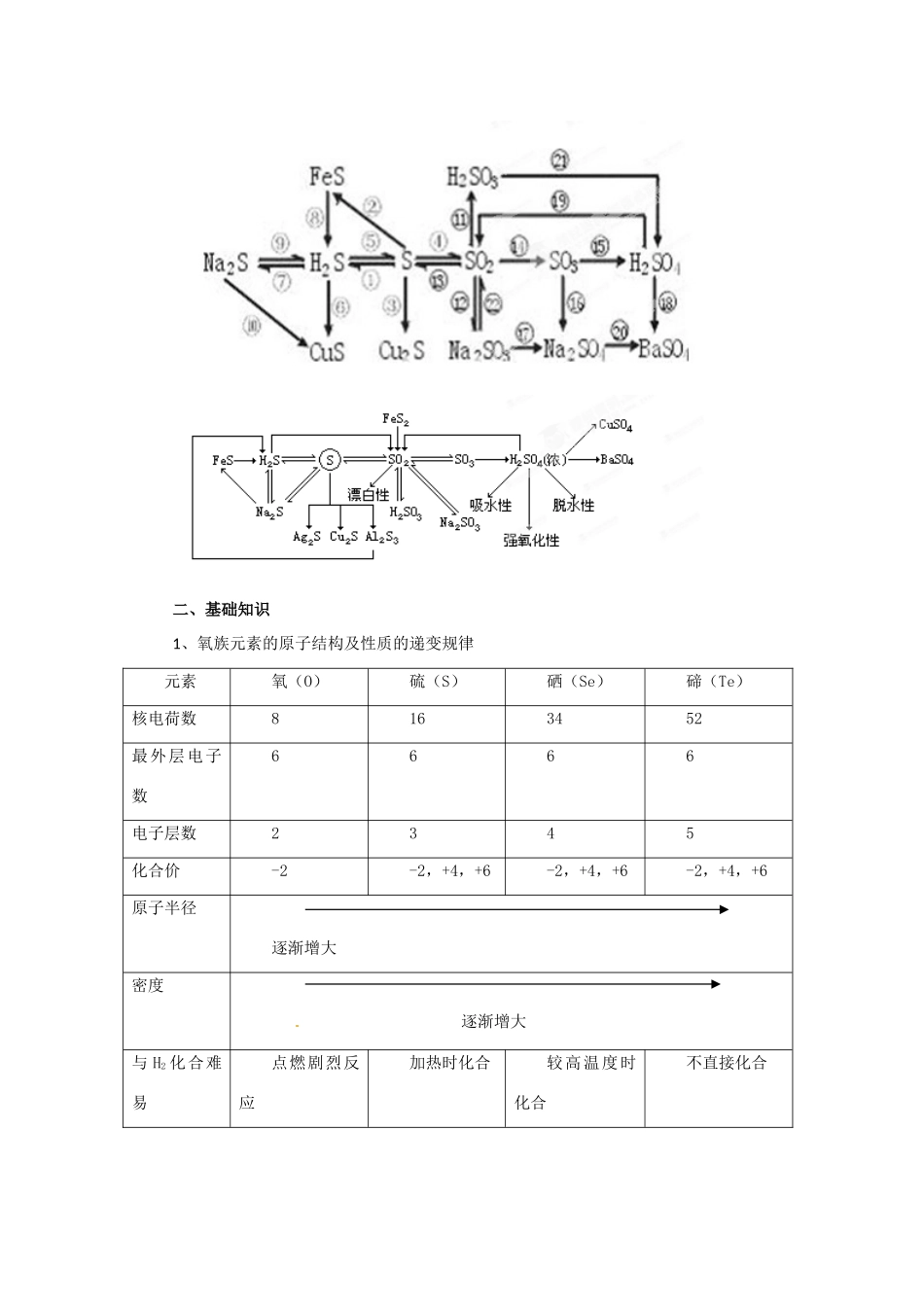
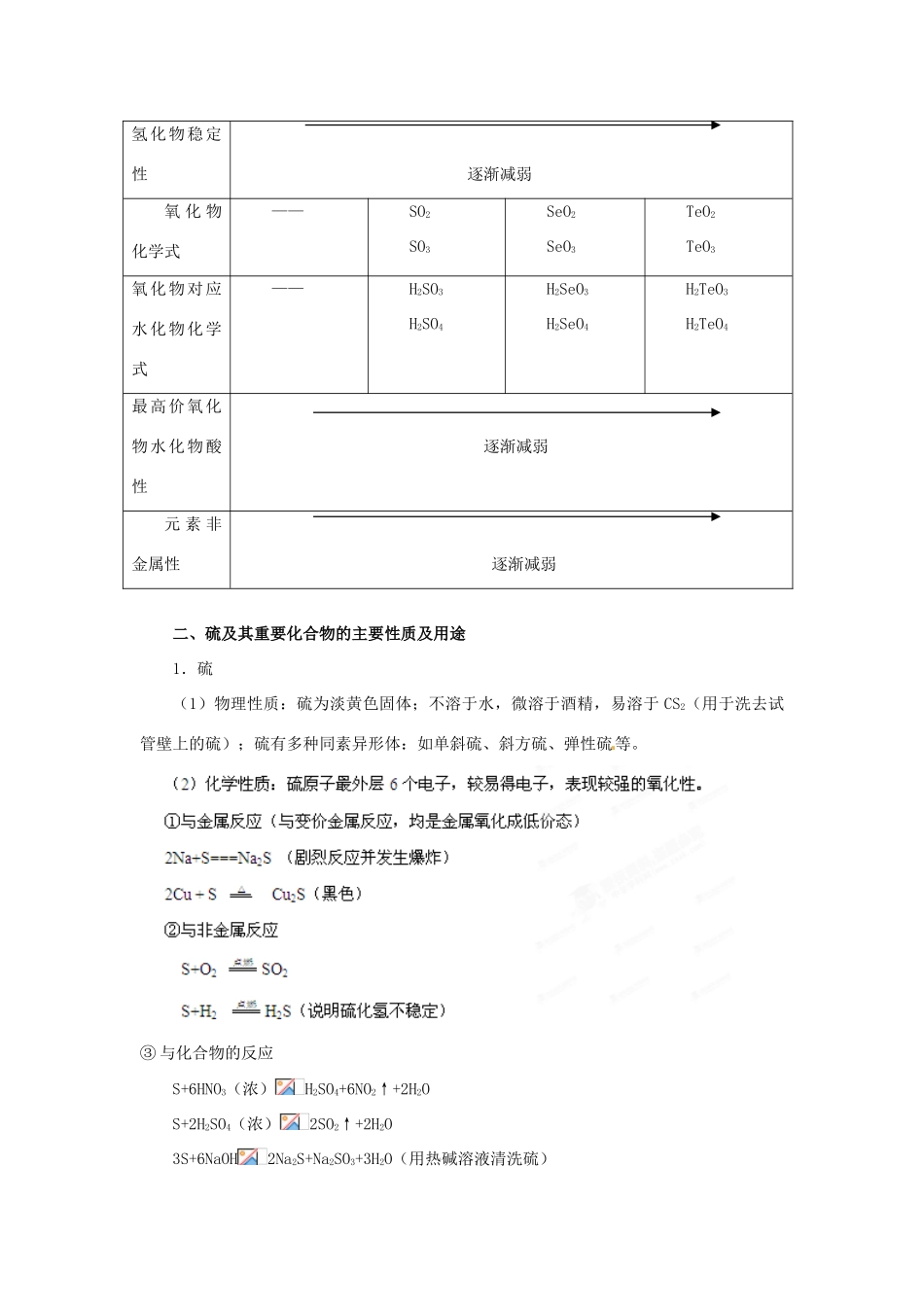
2013 届高考化学一轮精品教学案 4.3 硫及其重要化合物(1)【2013 考纲解读】 考纲内容能力要求考向定位1.了解常见非金属单质及其重要化合物的主要性质及应用。 2.了解常见非金属单质及其重要化合物对环境质量的影响。1 . 从 硫 的 原 子 结构,理解硫单质的化学性质。2.从化合价的角度认 识 SO2 氧 化 性 和 还 原性,理解 SO2 的漂白与氯水、过氧化钠等漂白的区别,了解实验室制备SO2 的反应原理和仪器装置。3 . 掌 握 硫 酸 的 性质、用途及硫酸根离子的检验,了解几种常见的硫酸盐。4.探究性验证硫酸盐、亚硫酸盐的性质。硫及其化合物的相互转化关系是高考的重要内容,主要的考点有:①二氧化硫的实验室制法;②二氧化硫的检验与净化;③+4 价硫的氧化性和还原性;④二氧化硫的漂白作用与氯气的漂白作用比较;⑤硫酸具有酸的通性和浓硫酸的特性;⑥ SO42的检验。今后的命题方向:①以硫及其化合物的相互转化关系为基础综合考查元素及化合物知识;②以二氧化硫和亚硫酸盐的氧化性和还原性为命题点,综合考查氧化还原反应的概念和计算;③以硫及其他元素形成的化合物为命题点,设计框图,综合考查推理能力、分析、综合等诸种思维能力。【重点知识梳理】一、知识体系二、基础知识 1、氧族元素的原子结构及性质的递变规律元素氧(O)硫(S)硒(Se)碲(Te)核电荷数8163452最外层电子数6666电子层数2345化合价-2-2,+4,+6-2,+4,+6-2,+4,+6原子半径逐渐增大密度 逐渐增大与 H2 化合难易点燃剧烈反应加热时化合较高温度时化合不直接化合氢化物稳定性 逐渐减弱氧 化 物化学式——SO2SO3SeO2SeO3TeO2TeO3氧化物对应水化物化学式——H2SO3H2SO4H2SeO3H2SeO4H2TeO3H2TeO4最高价氧化物水化物酸性 逐渐减弱元 素 非金属性 逐渐减弱二、硫及其重要化合物的主要性质及用途1.硫(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于 CS2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。③ 与化合物的反应S+6HNO3(浓)H2SO4+6NO2↑+2H2OS+2H2SO4(浓)2SO2↑+2H2O3S+6NaOH2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。2.硫的氢化物H2S 是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大硫化氢的化学性质A.可燃性:当≥2/1 时,2H2S+O2 2S+2H2O(H2S 过量) 当≤2/3 时,2H2S+3...