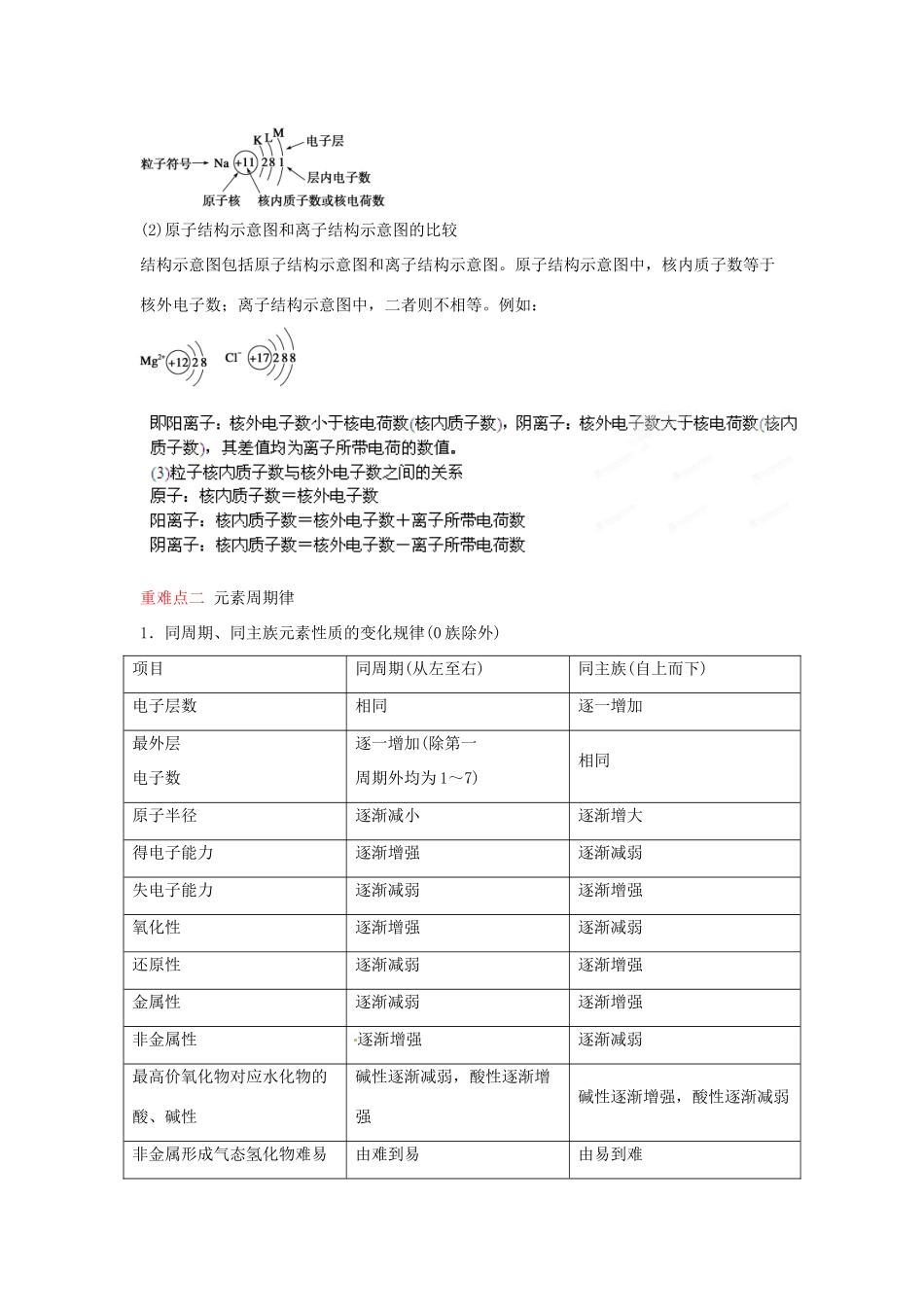
2013 届高考化学一轮精品教学案 5.3 化学键(1)【2013 高考考纲】1.了解离子键、共价键、离子化合物、共价化合物的概念。2.了解化学键的概念,会用电子式表示化合物及其形成过程。3.了解物质变化过程中化学键的变化。【重点知识梳理】重难点一 原子核外电子的排布 (3)最外层电子数排满 8 个(He 为 2 个)形成稳定结构,不易得失电子,化学性质稳定。(4)最外层电子较少的(<4)一般易失去电子达到稳定结构,表现出金属性;最外层电子较多的(>4)一般易得电子或通过形成共用电子对形成稳定结构,表现出非金属性。3.粒子的结构示意图(1)表示方法结构示意图是用小圆圈和圆圈内的符号及数字表示原子核及核内质子数,弧线表示各电子层,弧线上的数字表示该电子层上的电子数。如:(2)原子结构示意图和离子结构示意图的比较结构示意图包括原子结构示意图和离子结构示意图。原子结构示意图中,核内质子数等于核外电子数;离子结构示意图中,二者则不相等。例如: 重难点二 元素周期律1.同周期、同主族元素性质的变化规律(0 族除外)项目同周期(从左至右)同主族(自上而下)电子层数相同逐一增加最外层电子数逐一增加(除第一周期外均为 1~7)相同原子半径逐渐减小逐渐增大得电子能力逐渐增强逐渐减弱失电子能力逐渐减弱逐渐增强氧化性逐渐增强逐渐减弱还原性逐渐减弱逐渐增强金属性逐渐减弱逐渐增强非金属性逐渐增强逐渐减弱最高价氧化物对应水化物的酸、碱性碱性逐渐减弱,酸性逐渐增强碱性逐渐增强,酸性逐渐减弱非金属形成气态氢化物难易由难到易由易到难程度气态氢化物稳定性逐渐增强逐渐减弱化合价最高正价由(+1)~(+7)价,负价(-4)~(-1)最高正价等于族序数,最低负价等于-(8-族序数)2.粒子半径大小比较 (5)对同一元素来讲,价态越高半径越小。如 r(Fe3+)