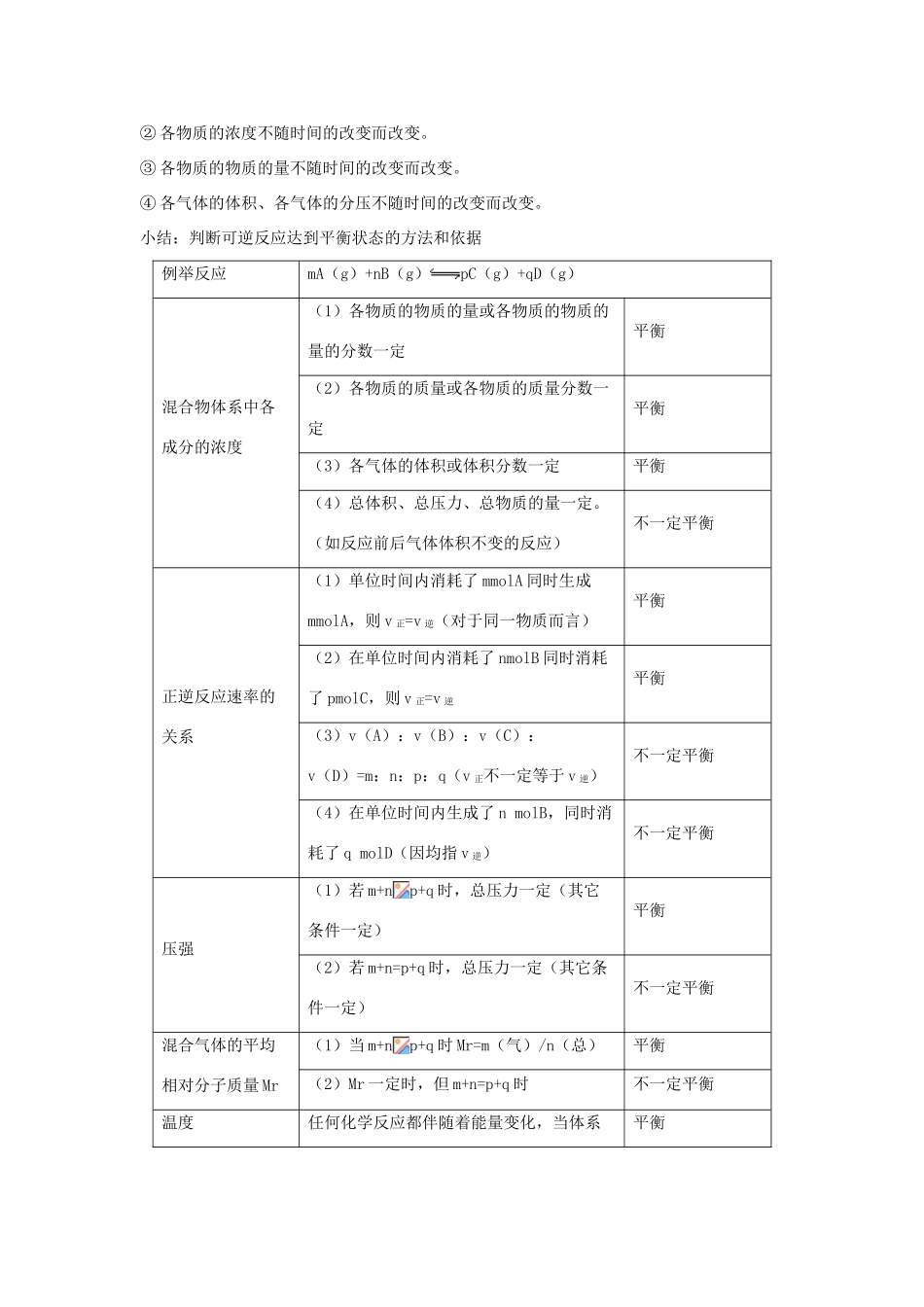
2013 届高考化学一轮精品教学案 7.2 化学平衡状态(1)【2013 考纲解读】考纲内容能力要求考向定位了解化学反应的可逆性了解化学平衡建立的过程。理解化学平衡标志判断及“同边异异边同”原理;本讲是高考是高考的重要内容,主要考点有:①化学平衡状态的理解及平衡的判定;②化学平衡常数和化学平衡计算今后的命题方向:化学平衡的理论是中学化学重要理论,高考会以新情境从多个方面来考查考生对这部分知识的理解和掌握水平。理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。理解化学平衡常数及其运用。理解“起”、“转”、“平”三步骤计算的技巧;掌握有关化学平衡的基本计算; 【重要知识梳理】一、化学平衡2.速度与平衡的关系(1),平衡向正反应方向移动。(2),平衡不移动。(3),平衡向逆反应方向移动。3.化学平衡的特点⑴“动”:化学平衡属于动态平衡,达到平衡时正反应和逆反应仍在进行。⑵“等”:v(正) = v(逆) > 0。平衡的重要原因是正反应速率等于逆反应速率。 ⑶“定”:平衡时组分的百分含量不变。反应物和生成物在整个体系中都含有,但是它们的百分含量一定,不再改变。⑷“变”:若条件改变,则化学平衡破坏,并在新条件下继续建立新的平衡。当改变条件,使 v(正) ≠ v(逆)时,平衡不再存在,反应继续向平衡方向进行。旖旎可逆反应总是向建立平衡的方向进行的。4.化学平衡状态的判断 可逆反应达到平衡时,V 正=V 逆,即单位时间内任一物质生成多少,就消耗多少。表现在外部的特点是:各物质的物质的量不变,总物质的量也不变,每一种物质的物质的量的百分含量也不变,混合气体的平均相对分子质量也不变,每种物质的浓度也不变,如温度、体积固定,反应容器内的总压,也不随时间的变化而变化。(但对反应前后气体物质分子数相等的可逆反应,就不能用总压、平均分子质量是否随时间变化来判断是否达到了平衡。)d.同时还可以推出:若有 1molN≡N 键断裂,则有 6molN-H 键断裂。② 各物质的百分含量保持不变。(2)间接(等价)标志:② 各物质的浓度不随时间的改变而改变。③ 各物质的物质的量不随时间的改变而改变。④ 各气体的体积、各气体的分压不随时间的改变而改变。小结:判断可逆反应达到平衡状态的方法和依据例举反应mA(g)+nB(g)pC(g)+qD(g)混合物体系中各成分的浓度(1)各物质的物质的量或各物质的物质的量的分数一定平衡(2)各物质的质量或各物质的质量分数一定平...