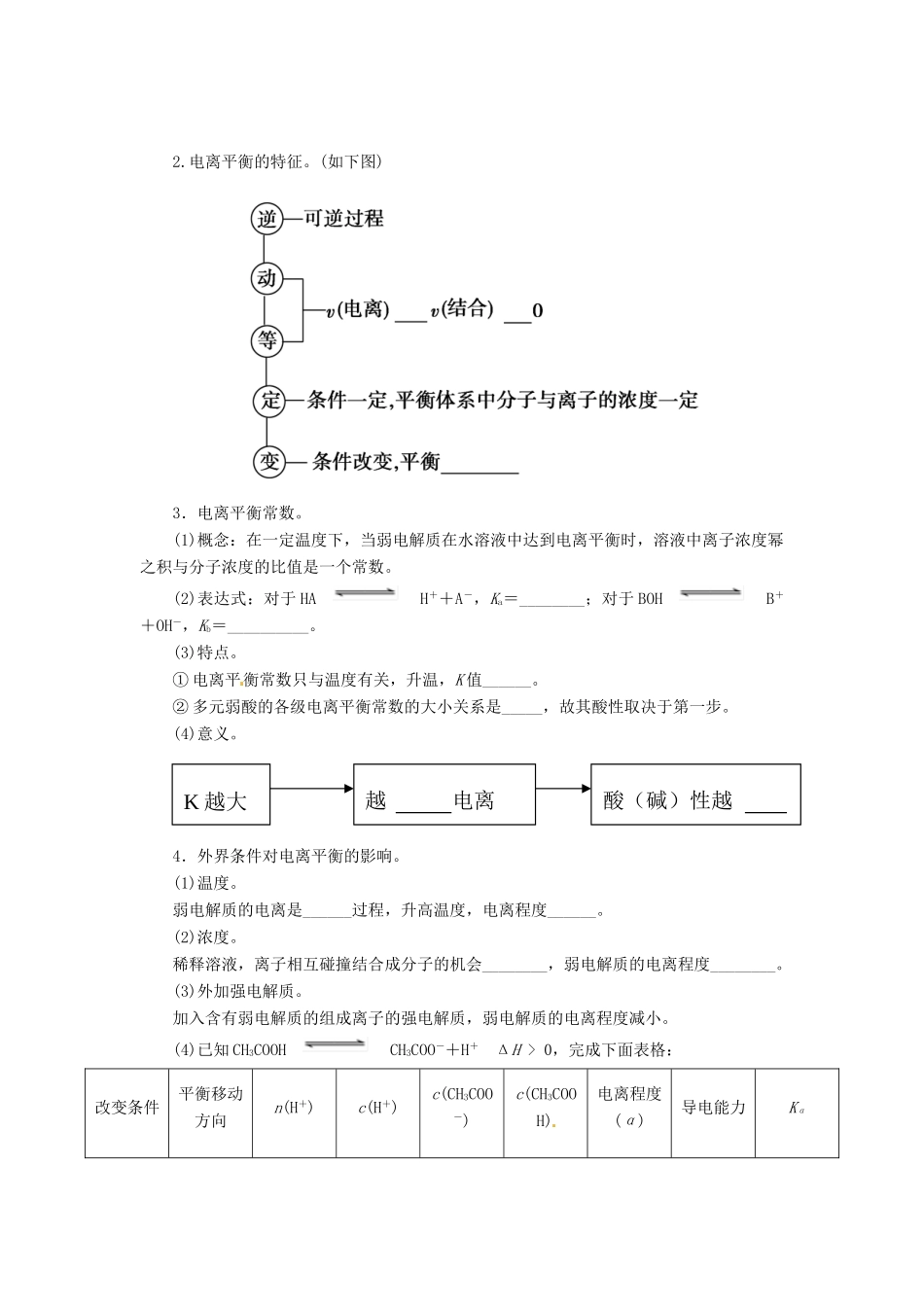
第一节 弱电解质的电离平衡梳理基础一、强电解质和弱电解质1.概念。2.电解质溶液的导电能力。自由移动离子______越大,____越多,溶液导电能力越强。二、弱电解质的电离平衡1.电离平衡的建立。在一定条件(如温度、浓度)下,当________的速率和______________的速率相等时,电离过程就达到了平衡状态。平衡建立过程如下图所示。1.了解电解质的概念,了解强电解质和弱电解质的概念。2.了解电解质在水溶液中的电离以及电解质溶液的导电性。3.了解弱电解质在水溶液中的电离平衡。2.电离平衡的特征。(如下图)3.电离平衡常数。(1)概念:在一定温度下,当弱电解质在水溶液中达到电离平衡时,溶液中离子浓度幂之积与分子浓度的比值是一个常数。(2)表达式:对于 HAH++A-,Ka=________;对于 BOHB++OH-,Kb=__________。(3)特点。① 电离平衡常数只与温度有关,升温,K 值______。② 多元弱酸的各级电离平衡常数的大小关系是_____,故其酸性取决于第一步。(4)意义。4.外界条件对电离平衡的影响。(1)温度。弱电解质的电离是______过程,升高温度,电离程度______。(2)浓度。稀释溶液,离子相互碰撞结合成分子的机会________,弱电解质的电离程度________。(3)外加强电解质。加入含有弱电解质的组成离子的强电解质,弱电解质的电离程度减小。(4)已知 CH3COOHCH3COO-+H+ ΔH > 0,完成下面表格:改变条件平衡移动方向n(H+)c(H+)c(CH3COO-)c(CH3COOH)电离程度(α)导电能力KαK 越大越 电离酸(碱)性越加水稀释加入少量冰醋酸加HCl(g)加NaOH(s)加入醋酸钠固体加入镁粉升高温度答案:梳理基础判断弱电解质的三个思考点思考一、弱电解质的定义,即弱电解质不能完全电离,如测 0.1 mol·L-1的 CH3COOH 溶液的 pH>1。思考二、弱电解质溶液中存在电离平衡,条件改变,平衡移动,如 pH=1 的 CH3COOH 加水稀释 10 倍 1<pH<2。思考三、弱电解质形成的盐类能水解,如判断 CH3COOH 为弱酸可用下面两个现象:配制某浓度的醋酸钠溶液,向其中加入几滴酚酞试液。现象:溶液变为浅红色。用玻璃棒蘸取一定浓度的醋酸钠溶液滴在 pH 试纸上,测其 pH。现象:pH>7。一、1.在水溶液里或熔融状态下 完全 部分 强酸、强碱、大多数盐 弱酸、弱碱、少数盐、水2.浓度 离子带电荷数二、1.电离 离子结合成分子2.= ≠ 发生移动3.(2) (3)① 增大 ② Ka1≫Ka2≫Ka3 (4)易 强4.(1)吸热 增大 (2)减...