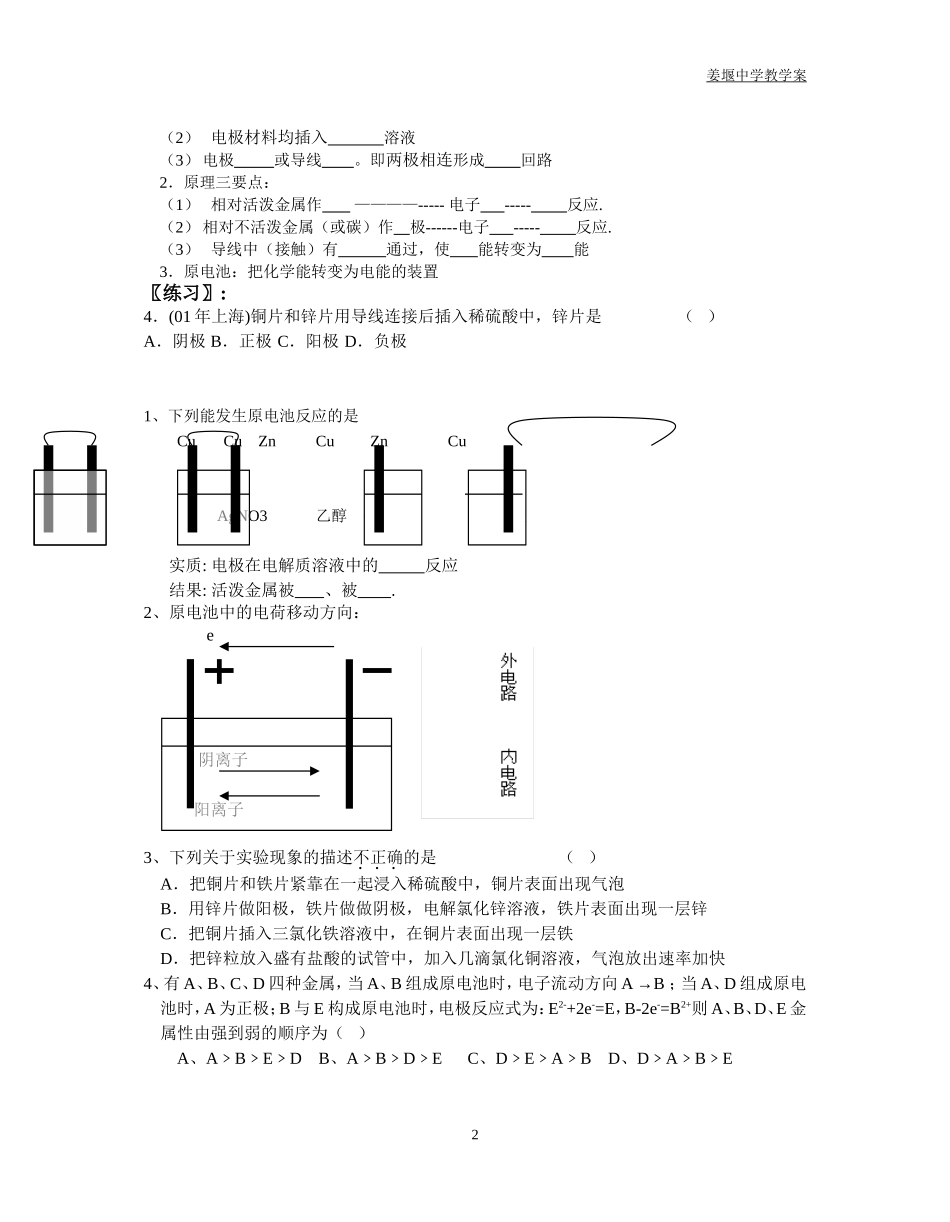
姜堰中学教学案原电池原理及应用(一) 教学目的要求:1、了解原电池的工作原理2、使学生掌握构成原电池的条件 教学重点难点:原电池的化学原理教 学 方 法:探索法(启发引导)教 学 过 程:引入:我们知道,物质发生化学反应时必然要有能量的变化,也就是说化学能常常与热能、光能等相互转化。比如在一般化学反应里,常表现出放热或吸热的现象,有的化学反应还伴随有发光,产生电流等等。今天我们主要探讨的是有关化学能是如何转变为电能。实验初中我们就已经学习过,活泼金属能与酸反应放出氢气,而不活泼金属就不能与酸反应置换氢气。(1)把一块锌片和一块铜片平行地插入盛有稀硫酸的烧杯中,观察现象Zn Cu 现象: 分析(方程式): H2SO4小结:金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属单质失电子能力:还原性由____ 到_______(填“强弱”)金属离子得电子能力:氧化性由____ 到_______(填“强弱”)(2)实验Zn Cu 现象:锌片不断 、铜片上有 、灵敏电流计指针发生 。 H2SO4结论:两极发生氧化还原反应,产生电流。(1)锌比铜活泼(2)氢离子在铜片上 电子变成 电极反应式:电极名称 片( 极)Zn === Zn2+(氧化反应)电极材料 片( 极)2H+ === H2 (还原反应)总化学方程式: 一. 原电池:1.原电池形成三条件:(1) 有两种 性不同的金属(或一种非金属导体)作电极正负 1姜堰中学教学案(2) 电极材料均插入 溶液(3) 电极 或导线 。即两极相连形成 回路2.原理三要点:(1) 相对活泼金属作 ————----- 电子 ----- 反应.(2) 相对不活泼金属(或碳)作 极------电子 ----- 反应.(3) 导线中(接触)有 通过,使 能转变为 能3.原电池:把化学能转变为电能的装置〖练习〗:4.(01 年上海)铜片和锌片用导线连接后插入稀硫酸中,锌片是 ( )A.阴极 B.正极 C.阳极 D.负极1、下列能发生原电池反应的是Cu Cu Zn Cu Zn Cu AgNO3 乙醇 硫酸 硫酸实质: 电极在电解质溶液中的 反应结果: 活泼金属被 、被 .2、原电池中的电荷移动方向: e 阴离子 阳离子 3、下列关于实验现象的描述不正确的是 ( )A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡B.用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁D.把锌粒放入盛有盐酸的试...