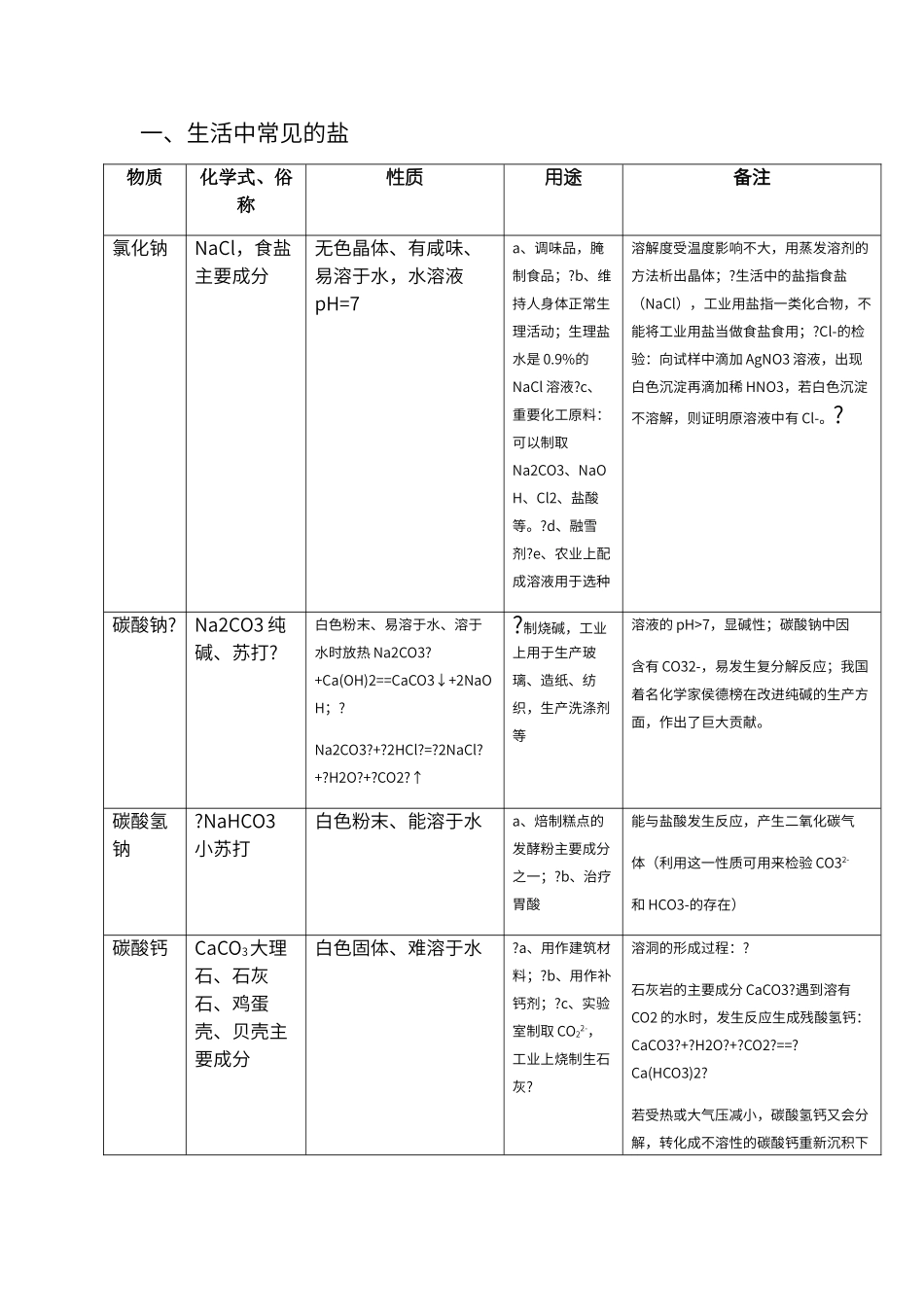
一、生活中常见的盐物质化学式、俗称性质用途备注氯化钠NaCl,食盐主要成分无色晶体、有咸味、易溶于水,水溶液pH=7a、调味品,腌制食品;?b、维持人身体正常生理活动;生理盐水是 0.9%的NaCl 溶液?c、重要化工原料:可以制取Na2CO3、NaOH、Cl2、盐酸等。?d、融雪剂?e、农业上配成溶液用于选种溶解度受温度影响不大,用蒸发溶剂的方法析出晶体;?生活中的盐指食盐(NaCl),工业用盐指一类化合物,不能将工业用盐当做食盐食用;?Cl-的检验:向试样中滴加 AgNO3 溶液,出现白色沉淀再滴加稀 HNO3,若白色沉淀不溶解,则证明原溶液中有 Cl-。?碳酸钠?Na2CO3 纯碱、苏打?白色粉末、易溶于水、溶于水时放热 Na2CO3?+Ca(OH)2==CaCO3↓+2NaOH;?Na2CO3?+?2HCl?=?2NaCl?+?H2O?+?CO2?↑?制烧碱,工业上用于生产玻璃、造纸、纺织,生产洗涤剂等溶液的 pH>7,显碱性;碳酸钠中因含有 CO32-,易发生复分解反应;我国着名化学家侯德榜在改进纯碱的生产方面,作出了巨大贡献。碳酸氢钠?NaHCO3小苏打白色粉末、能溶于水a、焙制糕点的发酵粉主要成分之一;?b、治疗胃酸能与盐酸发生反应,产生二氧化碳气体(利用这一性质可用来检验 CO32-和 HCO3-的存在)碳酸钙CaCO3大理石、石灰石、鸡蛋壳、贝壳主要成分白色固体、难溶于水?a、用作建筑材料;?b、用作补钙剂;?c、实验室制取 CO22-,工业上烧制生石灰?溶洞的形成过程:?石灰岩的主要成分 CaCO3?遇到溶有CO2 的水时,发生反应生成残酸氢钙:CaCO3?+?H2O?+?CO2?==?Ca(HCO3)2?若受热或大气压减小,碳酸氢钙又会分解,转化成不溶性的碳酸钙重新沉积下来:?Ca(HCO3)2??△?CaCO3?+?CO2↑?+?H2O?日久天长,沉积在洞顶的形成钟乳石,沉积在洞底的形成石笋,当钟乳石和石笋相连时就形成了石柱二、粗盐提纯?1、粗盐中还有较多可溶性杂质(MgCl2、CaCl2deng?)和不溶性杂志(泥沙等)?粗盐提纯的原理:1)用过滤的方法除去不溶性杂质;2)根据氯化钠的溶解度曲线用蒸发结晶的方法除去可溶性杂质。2、提纯步骤:?溶解:用天平称取食盐,用量筒量取水,放入烧杯,用玻璃棒搅拌?过滤:一贴、二低、三紧靠。如滤液仍浑浊,应再过滤一次。???????实验仪器有:烧杯(两个)、漏斗、滤纸、玻璃棒、带有铁圈的铁架台 ? 蒸发结晶:将所得澄清滤液倒入蒸发皿中,把蒸发皿放在铁架台的铁圈上,用酒精灯加热,并用玻璃棒不断搅拌,出现比较多固体时,停止加热。?计算产率:用玻璃棒把固体转移到纸上,称量。产率=精盐的...