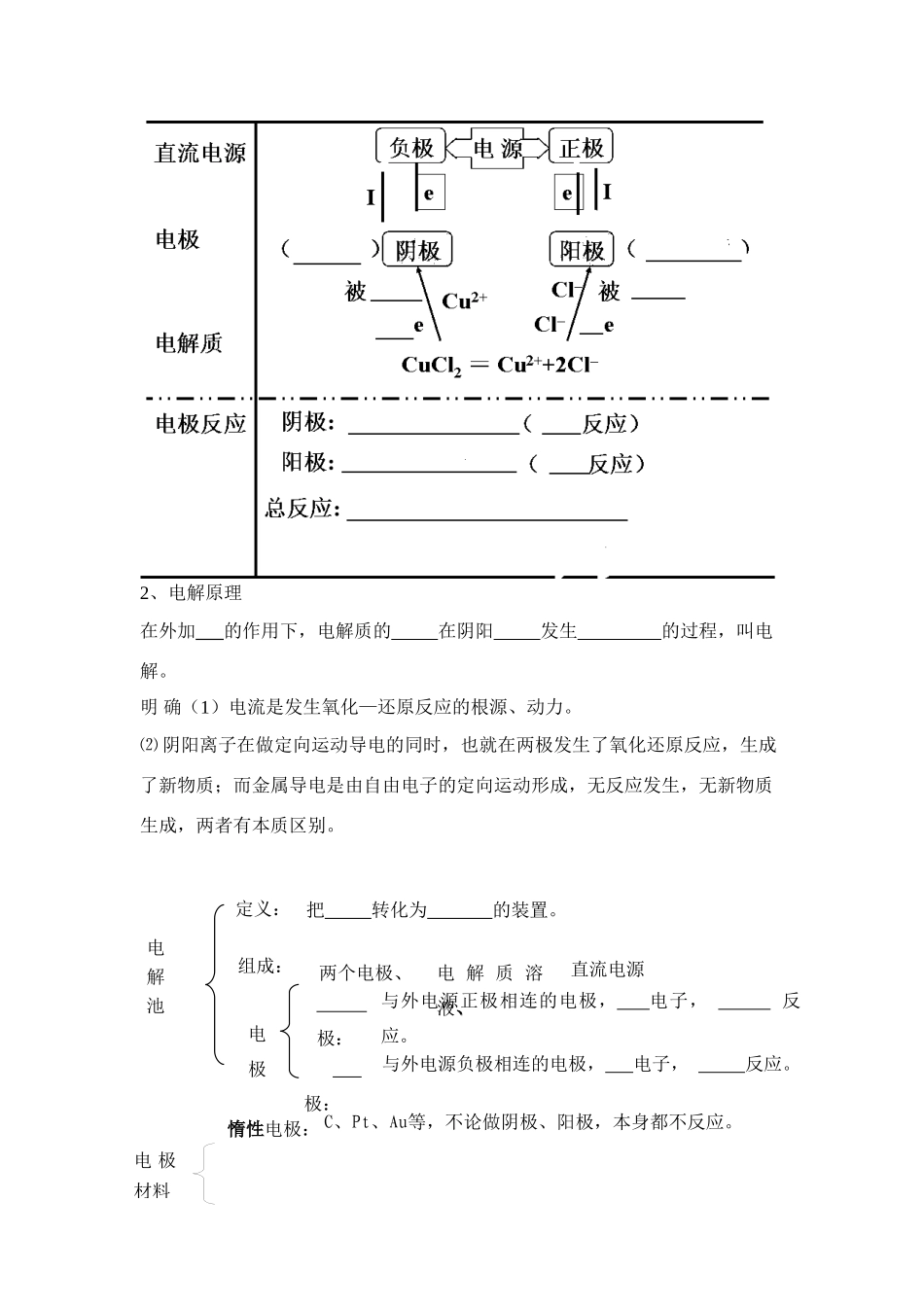
第三节 电解池学习目标:了解电解池的工作原理,知道电解在氯碱工业、电镀、电冶金方面的应用。学习重点、难点:电解池的工作原理学习过程:【温习旧知】1、电解质是指在__________ _ __能够导电的化合物。2、电离是指电解质在_____________或__________状态下离解成____________的过程。3、原电池是_______ ______的装置 。4、写出下列物质的电离方程式 CuCl2 H2O NaHSO4 CH3COONH4 【学习新知】一、电解原理【自学指导一】观察实验 4-2,回答实验现象得出实验结论。实验现象: 实验结论:电解质通电前在水溶液中自由移动的阴、阳离子作______________运动;在外电源的作用下(直流电),改作_________移动而导电。在导电的同时,在阳、阴两极发生氧化—还原反应,即被电解,电离是__________的前题。 【知识总结】1、电解氯化铜原理2、电解原理在外加 的作用下,电解质的 在阴阳 发生 的过程,叫电解。明 确(1)电流是发生氧化—还原反应的根源、动力。⑵ 阴阳离子在做定向运动导电的同时,也就在两极发生了氧化还原反应,生成了新物质;而金属导电是由自由电子的定向运动形成,无反应发生,无新物质生成,两者有本质区别。C、Pt、Au等,不论做阴极、阳极,本身都不反应。与外电源正极相连的电极, 电子, 反应。与外电源负极相连的电极, 电子, 反应。定义:把 转化为 的装置。组成:两个电极、、电 解 质 溶液、、直流电源电极 极: 极:电 解 池惰性电极:电 极材料3、构成电解池的条件:① 直流电源;4.电解池电极反应规律(阳氧阴还)(1)阴极: 电子, 反应 ① 电极本身不参加反应 ② 一定是电解质溶液中阳离子“争”得电子(2)阳极: 电子, 反应 ① 若为金属(非惰性)电极,电极失电子 ② 若为惰性电极,电解质溶液中阴离子“争”失电子 (3)离子放电顺序阴离子失去电子而阳离子得到电子的过程叫放电。阳极:① 活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不容易在电极上放电。② 用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由难到易)是:S 2->SO32->I ->Br ->Cl ->OH ->NO3 ->SO42-(等含氧酸根离子)>F-阴极:无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子在阴极上放电顺序是:Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)> Al3+>Mg2+>Na+>Ca+>K+Fe、Cu、Ag等,做阴极本身 反应,做阳极,本身 溶...