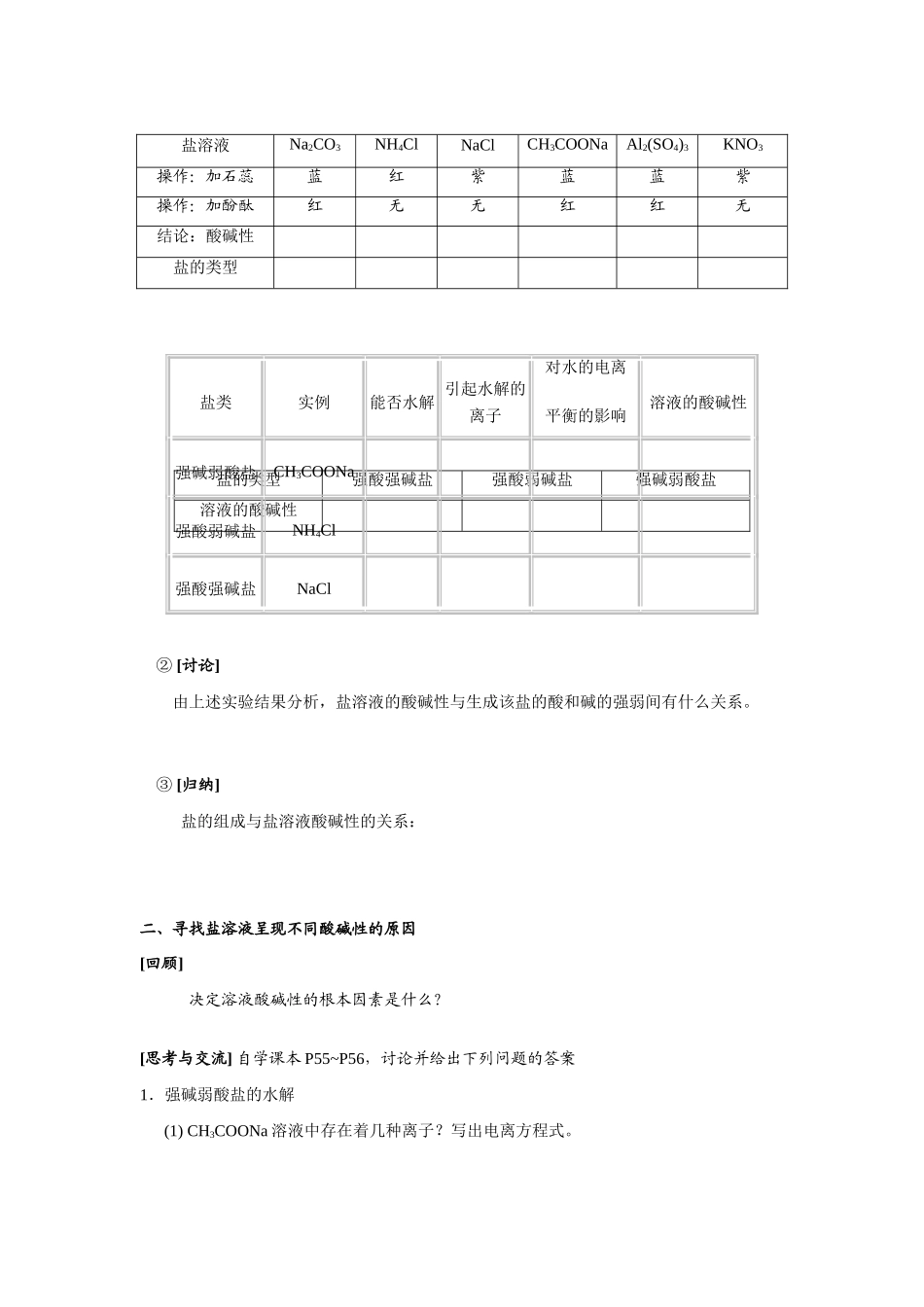
【 第三节】 盐类的水解【高考说明】 1、 了解盐类水解的原理,能说明影响盐类水解程度的主要因素,认识盐类水解在生产生活中的应用(弱酸弱碱的水解不作要求)。第 1 课时【学习目标】1.理解强碱弱酸盐和强酸弱碱盐的水解的过程,掌握盐类水解的本质。2.掌握盐类水解方程式的书写方法。3.学会分析问题,学会透过现象看本质。【学习重点】盐类水解的本质【学习难点】盐类水解方程式的书写和分析【学习过程】【旧知回顾】 1、 中和反应的实质是什么?2、 在盐酸溶液中存在着哪些平衡?在醋酸溶液中存在着哪些平衡?(用方程式表达)醋酸的存在对水的电离平衡有什么影响?3、 盐的分类:从形成盐的酸与碱的强弱角度,可将盐分为四类: ___________、_________、_________、_____________。【新知讲解】一、探究盐溶液的酸碱性 [科学探究] 阅读课本 P54,观察实验① 根据实验结果填写下表:② [讨论]由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系。③ [归纳]盐的组成与盐溶液酸碱性的关系:二、寻找盐溶液呈现不同酸碱性的原因[回顾] 决定溶液酸碱性的根本因素是什么?[思考与交流] 自学课本 P55~P56,讨论并给出下列问题的答案1.强碱弱酸盐的水解(1) CH3COONa 溶液中存在着几种离子?写出电离方程式。盐溶液Na2CO3NH4ClNaClCH3COONaAl2(SO4)3KNO3操作:加石蕊蓝红紫蓝蓝紫操作:加酚酞红无无红红无结论:酸碱性盐的类型盐的类型强酸强碱盐强酸弱碱盐强碱弱酸盐溶液的酸碱性盐类实例能否水解引起水解的离子对水的电离平衡的影响溶液的酸碱性强碱弱酸盐CH3COONa强酸弱碱盐NH4Cl强酸强碱盐NaCl(2) 溶液中哪些离子可能相互结合,对水的电离平衡有何影响?为什么 CH3COONa 溶液显碱性?(3) 写出 CH3COONa 溶液水解的化学方程式和离子方程式。2.强酸弱碱盐的水解[自我检查]应用盐类水解的原理,分析 NH4Cl 溶液显酸性的原因,并写出有关的离子方程式。三、盐类的水解:[归纳] 1、定义________________________________________________________叫做盐类的水解。2、盐类水解的实质: 在水溶液中盐电离出的阳离子(或阴离子)结合水电离出的________离子(或________离子),破坏了水的电离平衡,___________水的电离,使得溶液中 H+或 OH-的浓度不等,因此溶液显示不同的酸性、碱性或中性。2、说明:(1)只有弱酸的阴离子或弱碱的阳离子才能与 H+或 OH-结合生成弱电解质。 (2)盐...