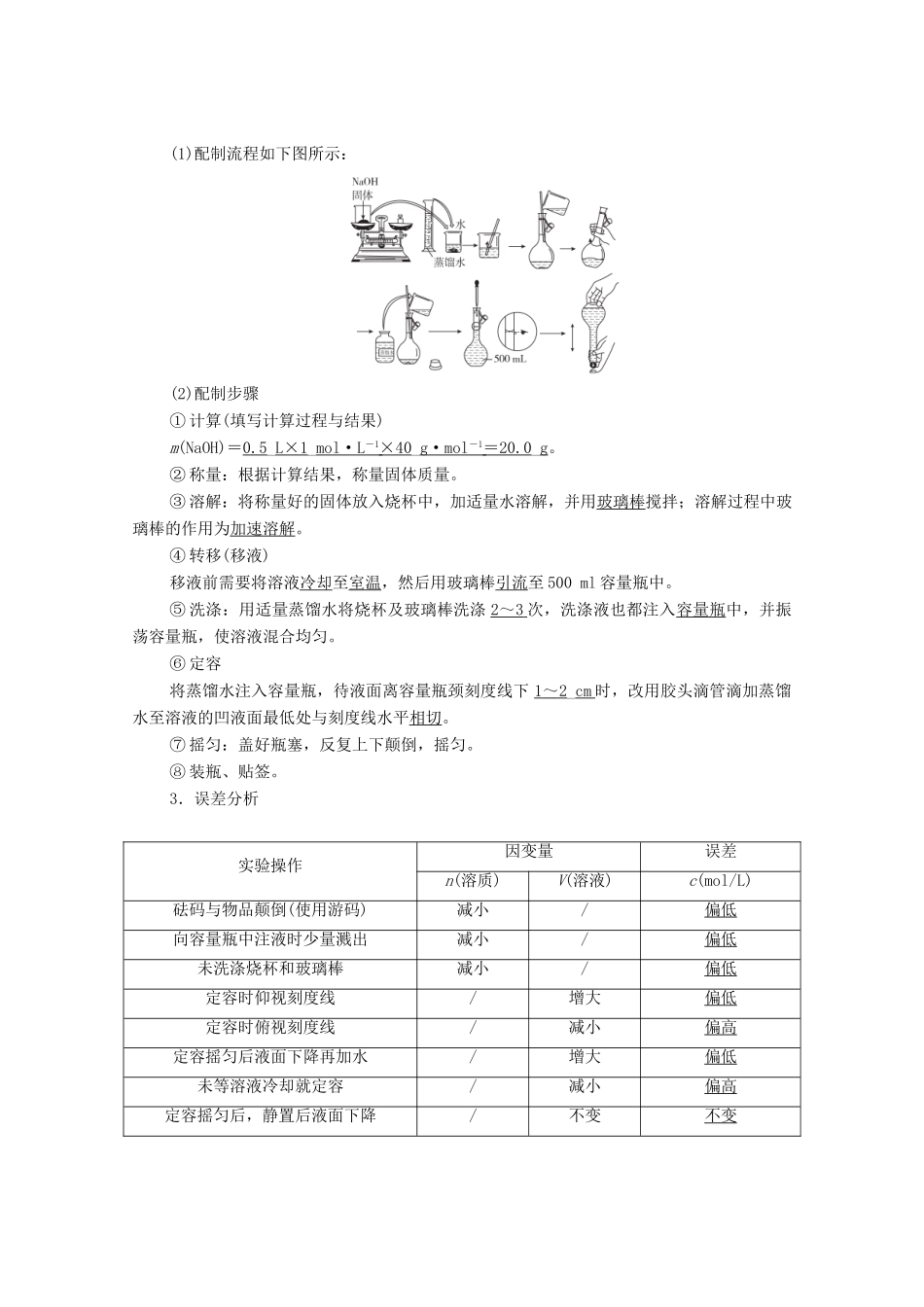
第 3 讲 物质的量浓度一、物质的量浓度二、物质的量浓度与溶质质量分数的比较内容物质的量浓度溶质质量分数定义以单位体积溶液中所含溶质的物质的量来表示溶液组成的物理量用溶质质量与溶液质量之比来表示溶液组成的物理量溶质的单位molg溶液的单位Lg计算公式c=w=×100%三、一定物质的量浓度溶液的配制1.主要仪器(1)托盘天平:称量前先调零,称量时药品放在左盘,砝码放在右盘,读数精确到 0.1 g。(2)容量瓶① 构造及三标记② 容量瓶使用前要先查漏后洗净。(3)其他仪器:量筒、烧杯、玻璃棒、胶头滴管等。2.配制过程以配制 480 mL 1 mol·L-1 NaOH 溶液为例,所需容量瓶的规格:500_mL。(1)配制流程如下图所示:(2)配制步骤① 计算(填写计算过程与结果)m(NaOH)=0.5_L×1_mol·L - 1 ×40 _g·mol - 1 = 20.0 _g。② 称量:根据计算结果,称量固体质量。③ 溶解:将称量好的固体放入烧杯中,加适量水溶解,并用玻璃棒搅拌;溶解过程中玻璃棒的作用为加速溶解。④ 转移(移液)移液前需要将溶液冷却至室温,然后用玻璃棒引流至 500 ml 容量瓶中。⑤ 洗涤:用适量蒸馏水将烧杯及玻璃棒洗涤 2 ~ 3 次,洗涤液也都注入容量瓶中,并振荡容量瓶,使溶液混合均匀。⑥ 定容将蒸馏水注入容量瓶,待液面离容量瓶颈刻度线下 1 ~ 2 _cm 时,改用胶头滴管滴加蒸馏水至溶液的凹液面最低处与刻度线水平相切。⑦ 摇匀:盖好瓶塞,反复上下颠倒,摇匀。⑧ 装瓶、贴签。3.误差分析实验操作因变量误差n(溶质)V(溶液)c(mol/L)砝码与物品颠倒(使用游码)减小/偏低向容量瓶中注液时少量溅出减小/偏低未洗涤烧杯和玻璃棒减小/偏低定容时仰视刻度线/增大偏低定容时俯视刻度线/减小偏高定容摇匀后液面下降再加水/增大偏低未等溶液冷却就定容/减小偏高定容摇匀后,静置后液面下降/不变不变1.判断正误,正确的画“√”,错误的画“×”,并指明错因。(1)1 mol·L-1 NaCl 溶液是指此溶液中含有 1 mol NaCl。(×)错因:1_mol·L - 1 _NaCl 溶液是指 1 _L 该溶液中含 1 _mol_NaCl 。 (2)从 100 mL 5 mol·L-1 H2SO4溶液中取出了 10 mL,所得硫酸的物质的量浓度为 0.5 mol·L-1。(×)错因:溶液的物质的量浓度与溶液的体积大小无关。(3)将 40 g SO3溶于 60 g 水中所得溶质的质量分数为 40%。(×)错因:SO3溶于水后溶质为 H2SO4,其质量分数为×98 g·mol-1÷100 g=49%。(4)用 100 ...