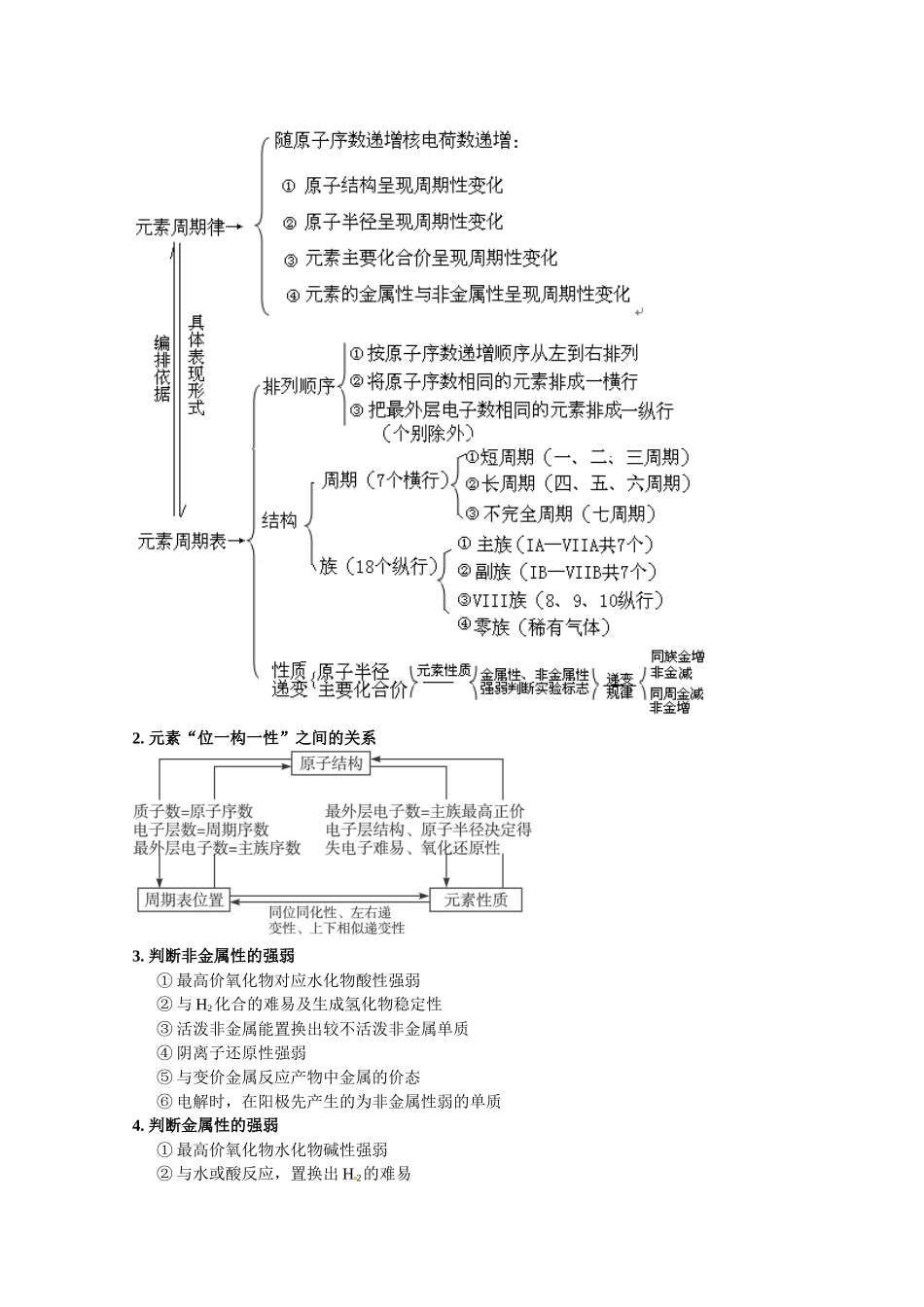
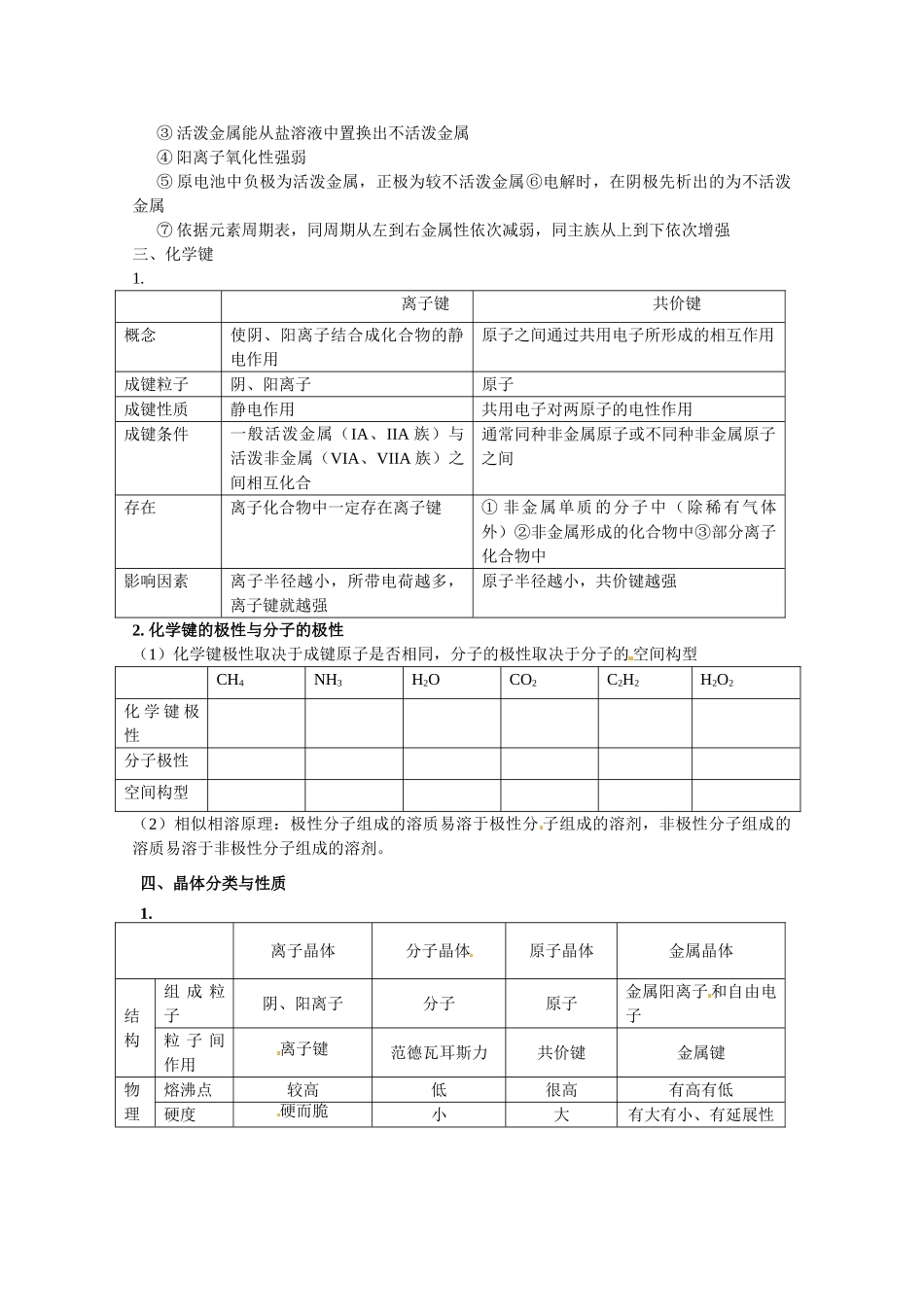
元素周期律 元素周期表 【教法指引】基本理论是化学主干知识,是学习元素化合物知识的理论基础,是中学化学的灵魂。在高考中占有很重要的地位,是每年高考的热点、重点和难点。复习本专题时注意元素的位构性三者关系在高考中经常出现,应予以关注。建议复习时要全面、熟练地掌握元素周期表、元素周期表及其性质变化规律。原子结构与元素周期表的关系非常重要,解题时审题要仔细,题意要清楚,化学用语要准确,杜绝非知识性的错误【知识网络】一、原子结构1. 2. 元素、核素、同位素(1)元素:具有相同质子数的同一类原子的总称。包括质子数相同的各种原子或离子(游离态和化合态)(2)核素:具有一定数目的质子和一定数目的中子的一种原子叫做核素。(3)同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。二、元素周期律和周期表1. 2. 元素“位一构一性”之间的关系3. 判断非金属性的强弱① 最高价氧化物对应水化物酸性强弱② 与 H2化合的难易及生成氢化物稳定性③ 活泼非金属能置换出较不活泼非金属单质④ 阴离子还原性强弱⑤ 与变价金属反应产物中金属的价态⑥ 电解时,在阳极先产生的为非金属性弱的单质4. 判断金属性的强弱① 最高价氧化物水化物碱性强弱② 与水或酸反应,置换出 H 2的难易③ 活泼金属能从盐溶液中置换出不活泼金属④ 阳离子氧化性强弱⑤ 原电池中负极为活泼金属,正极为较不活泼金属⑥电解时,在阴极先析出的为不活泼金属⑦ 依据元素周期表,同周期从左到右金属性依次减弱,同主族从上到下依次增强 三、化学键1.离子键共价键概念使阴、阳离子结合成化合物的静电作用原子之间通过共用电子所形成的相互作用成键粒子阴、阳离子原子成键性质静电作用共用电子对两原子的电性作用成键条件一般活泼金属(IA、IIA 族)与活泼非金属(VIA、VIIA 族)之间相互化合通常同种非金属原子或不同种非金属原子之间存在离子化合物中一定存在离子键① 非金属单质的分子中(除稀有气体外)②非金属形成的化合物中③部分离子化合物中影响因素离子半径越小,所带电荷越多,离子键就越强原子半径越小,共价键越强2. 化学键的极性与分子的极性(1)化学键极性取决于成键原子是否相同,分子的极性取决于分子的 空间构型CH4NH3H2OCO2C2H2H2O2化 学 键 极性分子极性空间构型(2)相似相溶原理:极性分子组成的溶质易溶于极性分 子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂。四、晶...