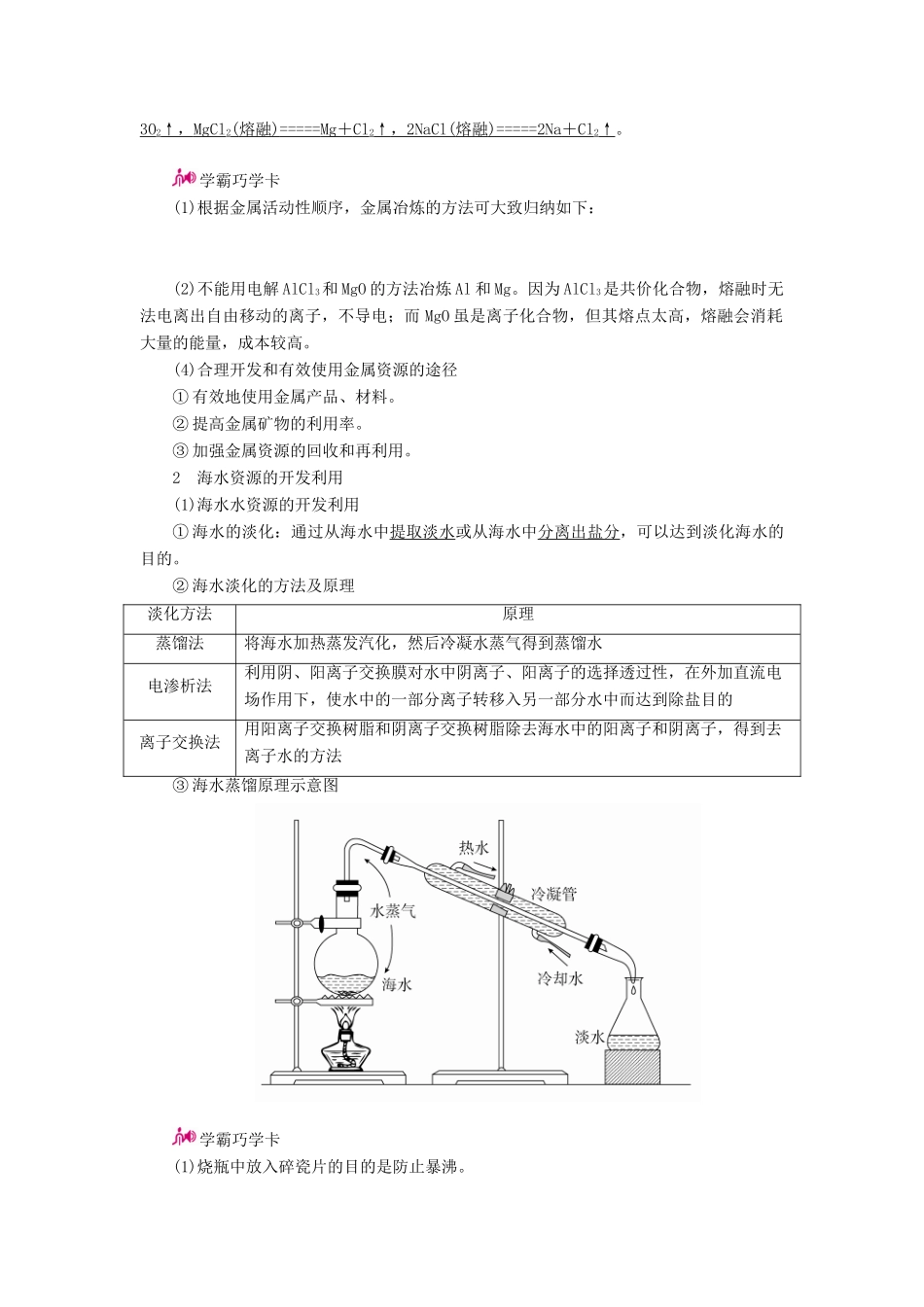
专题二十二 化学与自然资源的开发利用考纲展示 命题探究1 金属矿物的开发利用(1)金属在自然界中的存在形态除了金、铂等极少数金属外,绝大多数金属元素以化合态的形式存在于自然界。在这些金属化合物中,金属元素显正化合价。(2)金属冶炼的步骤步骤一般方法或原理 目的矿石富集采矿、选矿、粉碎、筛矿、洗矿等除去杂质、提高矿石中有用成分的含量冶炼利用氧化还原反应原理,在一定条件下用还原剂把金属从金属矿物中还原成金属单质得到粗金属单质(含少量杂质)精炼加入除杂试剂或电解精炼 提炼得到纯金属(3)金属的冶炼方法① 热分解法(适用于 Hg、Ag 等不活泼金属)例如:2HgO=====2Hg+O2↑,2Ag2O=====4Ag+O2↑。用热分解冶炼法冶炼金属的特点:金属元素的金属性弱,金属元素的原子不易失去电子,其金属离子容易得到电子,该金属元素所形成的化合物稳定性较差。② 热还原法(适用于 Zn~Cu 等中等活泼金属)a.焦炭还原法。例如:C 还原 ZnO、CuO,其化学方程式依次为 C + 2ZnO ===== 2Zn + CO2↑ , C + 2CuO ===== 2Cu + CO 2↑。b.一氧化碳还原法。例如: CO 还原 Fe2O3、CuO,其化学方程式依次为 3CO + Fe2O3===== 2Fe + 3CO 2, CO + CuO ===== Cu + CO 2。c.氢气还原法。例如:H2 还原 WO3、Fe3O4,其化学方程式依次为 3H2+ WO 3===== W + 3H2O,4H2+ Fe 3O4===== 3Fe + 4H 2O。d.活泼金属还原法。例如: Al 还原 Cr2O3、V2O5,其化学方程式依次为 2Al + Cr2O3===== Al 2O3+ 2Cr,10Al + 3V 2O5===== 6V + 5Al 2O3。③ 电解法(适用于 Al 以前的活泼金属)例如:Al2O3、MgCl2、NaCl 的电解反应,其化学方程式依次为 2Al2O3( 熔融 ) ===== 4Al + 3O2↑ , MgCl 2( 熔融 ) ===== Mg + Cl 2↑ , 2NaCl( 熔融 ) ===== 2Na + Cl 2↑。学霸巧学卡(1)根据金属活动性顺序,金属冶炼的方法可大致归纳如下: (2)不能用电解 AlCl3和 MgO 的方法冶炼 Al 和 Mg。因为 AlCl3是共价化合物,熔融时无法电离出自由移动的离子,不导电;而 MgO 虽是离子化合物,但其熔点太高,熔融会消耗大量的能量,成本较高。(4)合理开发和有效使用金属资源的途径① 有效地使用金属产品、材料。② 提高金属矿物的利用率。③ 加强金属资源的回收和再利用。2 海水资源的开发利用(1)海水水资源的开发利用① 海水的淡化:通过从海...