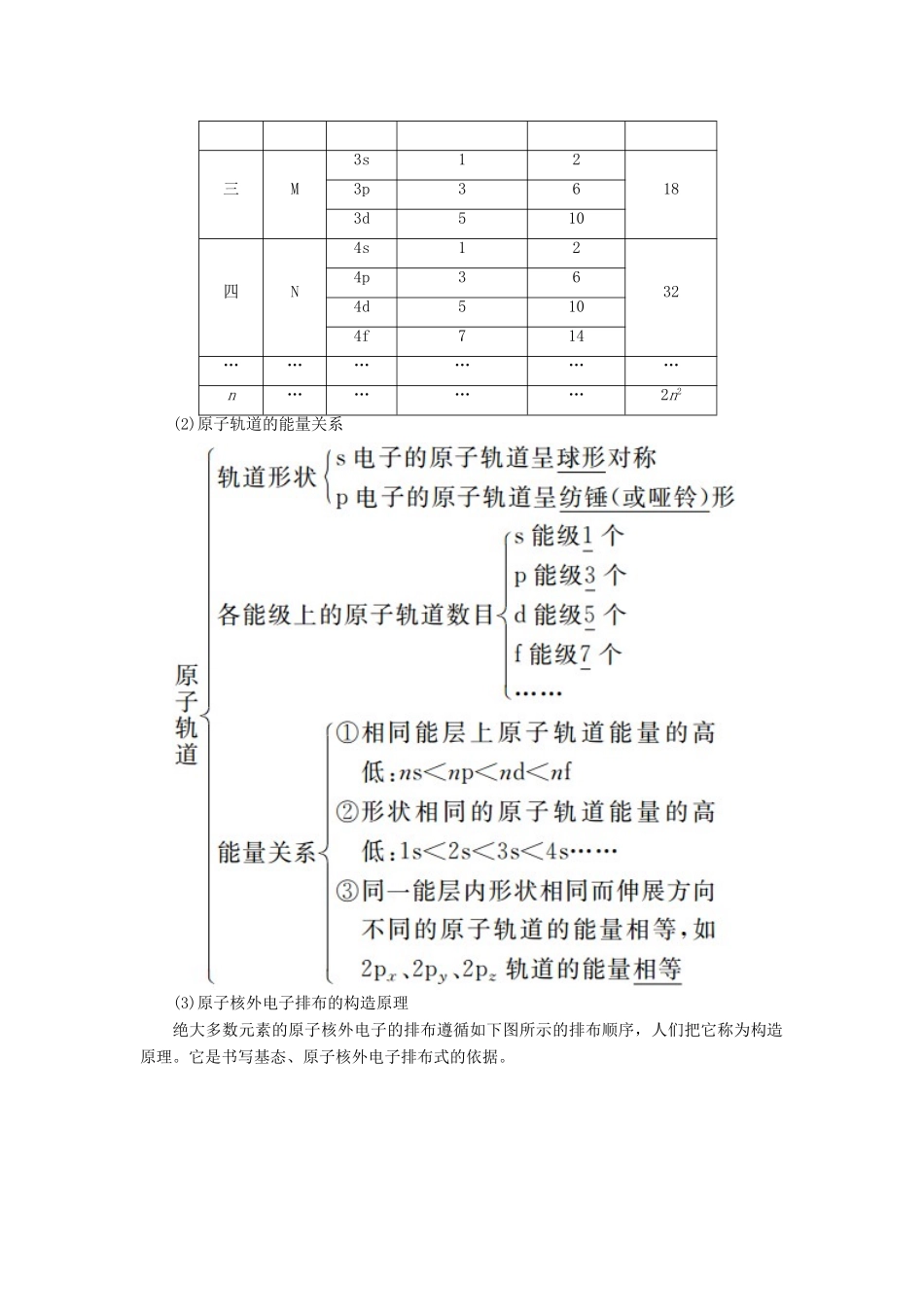
专题二十七 物质的结构与性质考纲展示 命题探究1 能层、能级与原子轨道(1)概念① 能层:原子核外电子是分层排布的,根据电子的能量差异,可将核外电子分成不同的能层(n);各能层最多可容纳的电子数为 2n2。② 能级:在多电子原子中,同一能层的电子,能量也可能不同,可将不同能量的电子分 成 不 同 的 能 级 ; 同 一 能 层 里 , 能 级 的 能 量 按 s 、 p 、 d 、 f 的 顺 序 升 高 , 即E(ns)E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。2 基态原子的核外电子排布(1)排布规律① 能量最低原理原子核外电子优先占有能量较低的轨道,然后依次进入能量较高的轨道,这样使整个原子处于能量最低的状态。学霸巧学卡所有电子排布规则都需满足能量最低原理。② 泡利原理每个原子轨道里最多只能容纳 2 个 电子,且自旋状态相反。如 2s 轨道上的电子排布为,不能表示为。③ 洪特规则当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且 自 旋 状 态 相 同 。 如 2p3 的 电 子 排 布 为, 不 能 表 示 为或。学霸巧学卡当 能 量 相 同 的 原 子 轨 道 在 全 充 满 (p6 、 d10 、 f14) 、 半 充 满 (p3 、 d5 、 f7) 或 全 空(p0、d0、f0)状态时,体系的能量最低,这一点违反了洪特规则,可看成洪特规则的特例。如 24Cr 的电子排布式:1s22s22p63s23p63d54s1(3d5、4s1均为半充满稳定状态);29Cu 的电子排布式:1s22s22p63s23p63d104s1(3d10为全充满稳定状态,4s1为半充满稳定状态)。(2)表示方法表示方法以硫原...