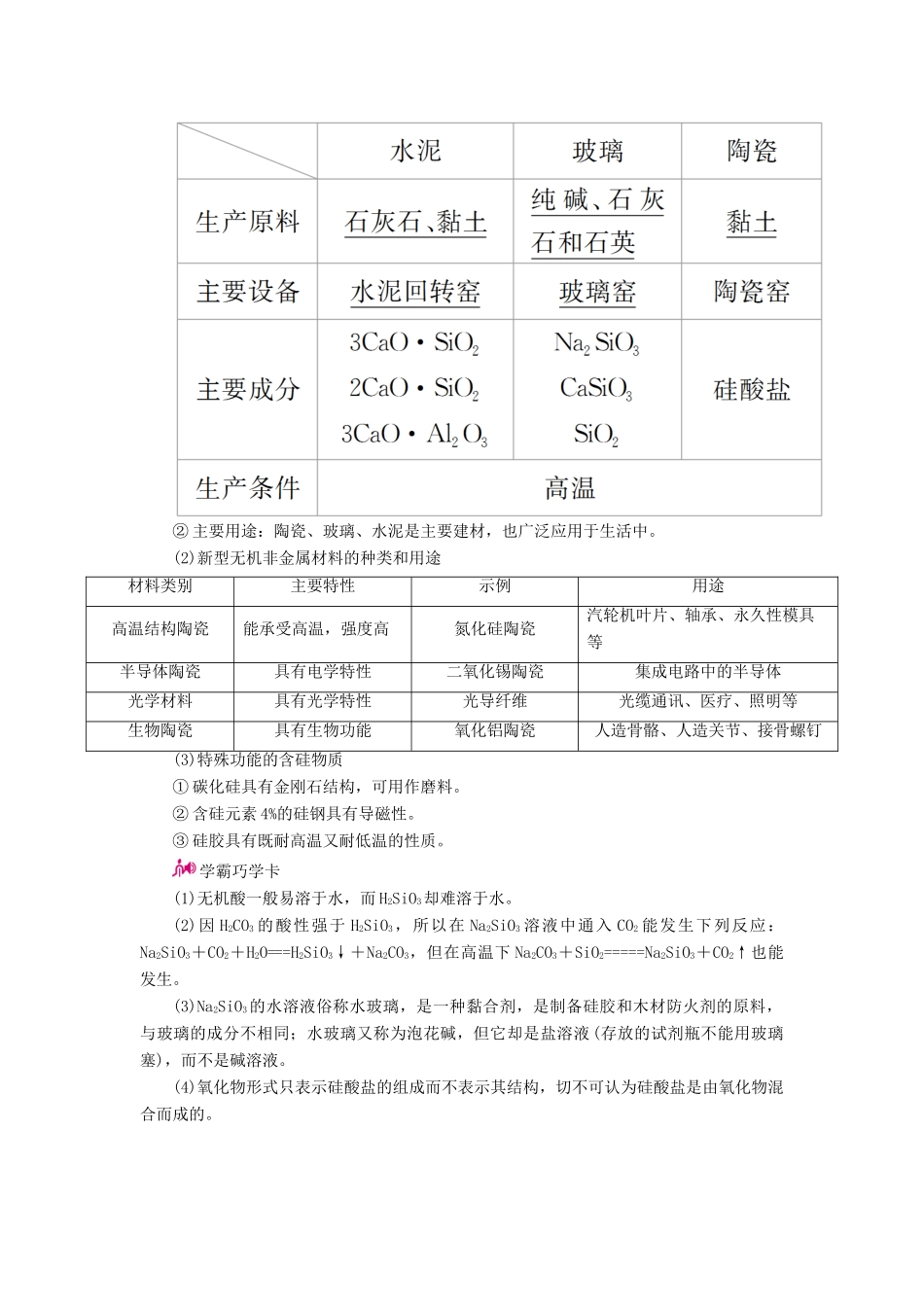
1 碳、硅元素的酸及其盐物质主要内容碳酸、硅酸水溶性H2CO3可溶于水,H2SiO3难溶于水不稳定性H2CO3CO2+H2O,H2SiO3=====SiO2+H2O酸性H2CO3>H2SiO3制备CO2+H2OH2CO3,SiO+2H+===H2SiO3↓(可溶性硅酸盐与其他酸反应制得)盐碳酸盐水溶性正盐(碳酸盐)除 K2CO3、Na2CO3和(NH4)2CO3外,其余均不溶于水;酸式盐(碳酸氢盐)全溶于水热稳定性部分碳酸盐高温分解,如 CaCO3;碳酸氢盐受热分解:Ca(HCO3)2=====CaCO3+H2O+CO2↑与酸反应CaCO3+2HCl===CaCl2+H2O+CO2↑,Ca(HCO3)2+2HCl===CaCl2+2H2O+2CO2↑与碱反应Ca(OH)2+Na2CO3===CaCO3↓+2NaOH,NaOH+NaHCO3===Na2CO3+H2O与盐反应CaCl2+Na2CO3===CaCO3↓+2NaCl硅酸盐含义由硅、氧以及金属元素组成的化合物的总称表示方法通常用二氧化硅和金属氧化物的组合形式来表示,如 Na2SiO3可表示为 Na2O·SiO2,长石(KAlSi3O8)可表示为 K2O·Al2O3·6SiO2主要性质① 除 K2SiO3、Na2SiO3外,其余硅酸盐均不溶于水;② Na2SiO3+H2O+CO2===H2SiO3↓+Na2CO3,SiO+2H+===H2SiO3↓2 无机非金属材料(1)传统无机非金属材料① 三种硅酸盐工业生产的比较② 主要用途:陶瓷、玻璃、水泥是主要建材,也广泛应用于生活中。(2)新型无机非金属材料的种类和用途材料类别主要特性示例用途高温结构陶瓷能承受高温,强度高氮化硅陶瓷汽轮机叶片、轴承、永久性模具等半导体陶瓷具有电学特性二氧化锡陶瓷集成电路中的半导体光学材料具有光学特性光导纤维光缆通讯、医疗、照明等生物陶瓷具有生物功能氧化铝陶瓷人造骨骼、人造关节、接骨螺钉(3)特殊功能的含硅物质① 碳化硅具有金刚石结构,可用作磨料。② 含硅元素 4%的硅钢具有导磁性。③ 硅胶具有既耐高温又耐低温的性质。学霸巧学卡(1)无机酸一般易溶于水,而 H2SiO3却难溶于水。(2)因 H2CO3 的酸性强于 H2SiO3,所以在 Na2SiO3 溶液中通入 CO2 能发生下列反应:Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,但在高温下 Na2CO3+SiO2=====Na2SiO3+CO2↑也能发生。(3)Na2SiO3的水溶液俗称水玻璃,是一种黏合剂,是制备硅胶和木材防火剂的原料,与玻璃的成分不相同;水玻璃又称为泡花碱,但它却是盐溶液(存放的试剂瓶不能用玻璃塞),而不是碱溶液。(4)氧化物形式只表示硅酸盐的组成而不表示其结构,切不可认为硅酸盐是由氧化物混合而成的。1.思维辨析(1)玻璃容器可长期盛放各种酸。( )(2)合成纤维和光导纤维都是新型无机非金属材料。(...