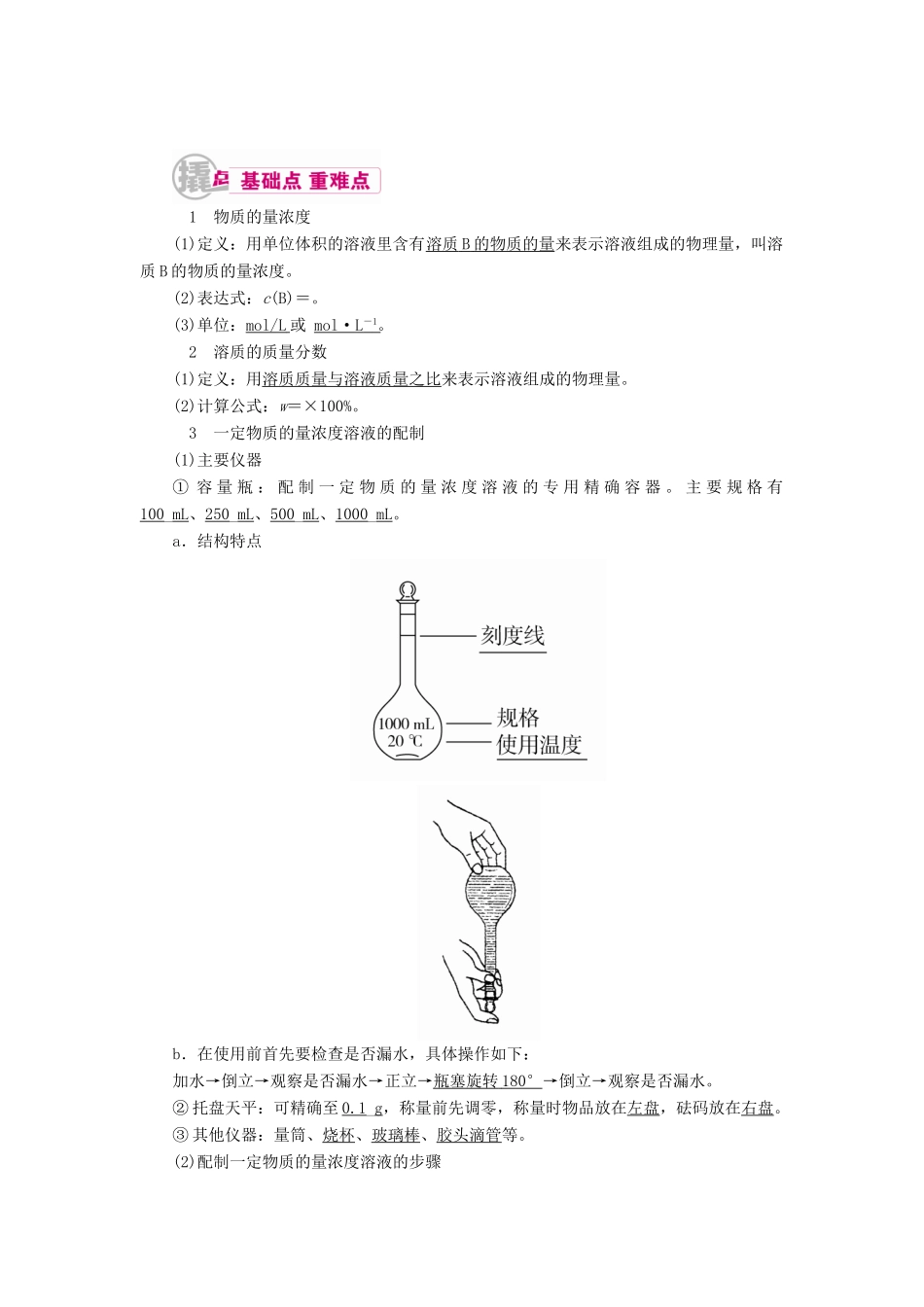
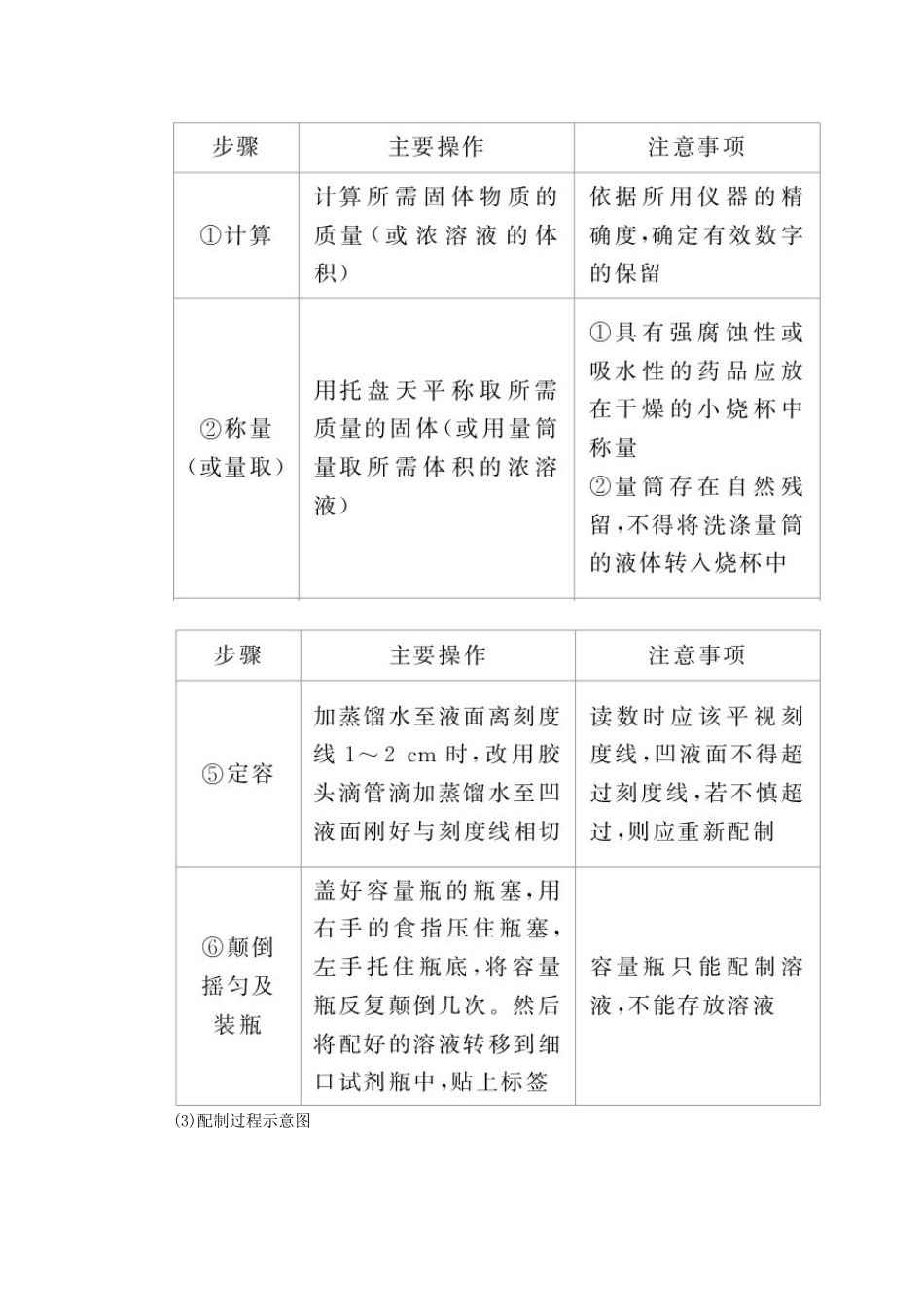
1 物质的量浓度(1)定义:用单位体积的溶液里含有溶质 B 的物质的量 来表示溶液组成的物理量,叫溶质 B 的物质的量浓度。(2)表达式:c(B)=。(3)单位:mol/L 或 mol·L - 1 。 2 溶质的质量分数(1)定义:用溶质质量与溶液质量之比来表示溶液组成的物理量。(2)计算公式:w=×100%。 3 一定物质的量浓度溶液的配制(1)主要仪器① 容 量 瓶 : 配 制 一 定 物 质 的 量 浓 度 溶 液 的 专 用 精 确 容 器 。 主 要 规 格 有100_mL、250_mL、500_mL、1000_mL。a.结构特点b.在使用前首先要检查是否漏水,具体操作如下:加水→倒立→观察是否漏水→正立→瓶塞旋转 180° →倒立→观察是否漏水。② 托盘天平:可精确至 0.1_g,称量前先调零,称量时物品放在左盘,砝码放在右盘。③ 其他仪器:量筒、烧杯、玻璃棒、胶头滴管等。(2)配制一定物质的量浓度溶液的步骤(3)配制过程示意图 学霸巧学卡 (1)使用 c(B)=公式的注意事项① 正确判断溶液的溶质并计算其物质的量。a.与水发生反应生成新的物质,如Na、Na2O、Na2O2――→NaOH,SO3――→H2SO4,NO2――→HNO3。b.特殊物质:如 NH3溶于水后溶质为 NH3·H2O,但计算浓度时仍以 NH3作为溶质。c.含结晶水的物质:CuSO4·5H2O―→CuSO4,Na2CO3·10H2O―→Na2CO3。②c=中的 V 是溶液的体积,不是溶剂的体积,也不是溶质和溶剂的体积之和。③ 配制一定质量分数的溶液,所选烧杯的规格一般应大于溶液体积的一倍。④ 在溶解度的概念中,“100”指的是 100 g 溶剂(通常是 H2O),而不是溶液。(2)容量瓶使用的注意事项① 选用容量瓶时必须注明容量瓶规格。如 500 mL 容量瓶。② 选择容量瓶时遵循“大而近”的原则,所需溶质的量按所选用的容量瓶的容积进行计算。如配制 480 mL 1 mol/L NaOH 溶液时应选用 500 mL 的容量瓶,所需溶质 NaOH 的物质的量为 0.5 mol。③ 向容量瓶中注入液体时,应沿细玻璃棒注入,以防操作时液体流出而损失。④ 容量瓶使用应注意“五不”:不能溶解固体,不能稀释浓溶液,所配溶液温度不能高于或低于室温,不能作反应容器,不能长期贮存所配溶液。1.思维辨析(1)欲配制 1 L 1 mol·L-1的 NaCl 溶液,可将 58.5 g NaCl 溶于 1 L 水中。( )(2)在 50 mL 量筒中配制 0.1000 mol·L-1碳酸钠溶液。( )(3)用 pH=1 的盐酸配制 100 mL pH=2 的盐酸只需要 100 mL 容量瓶...