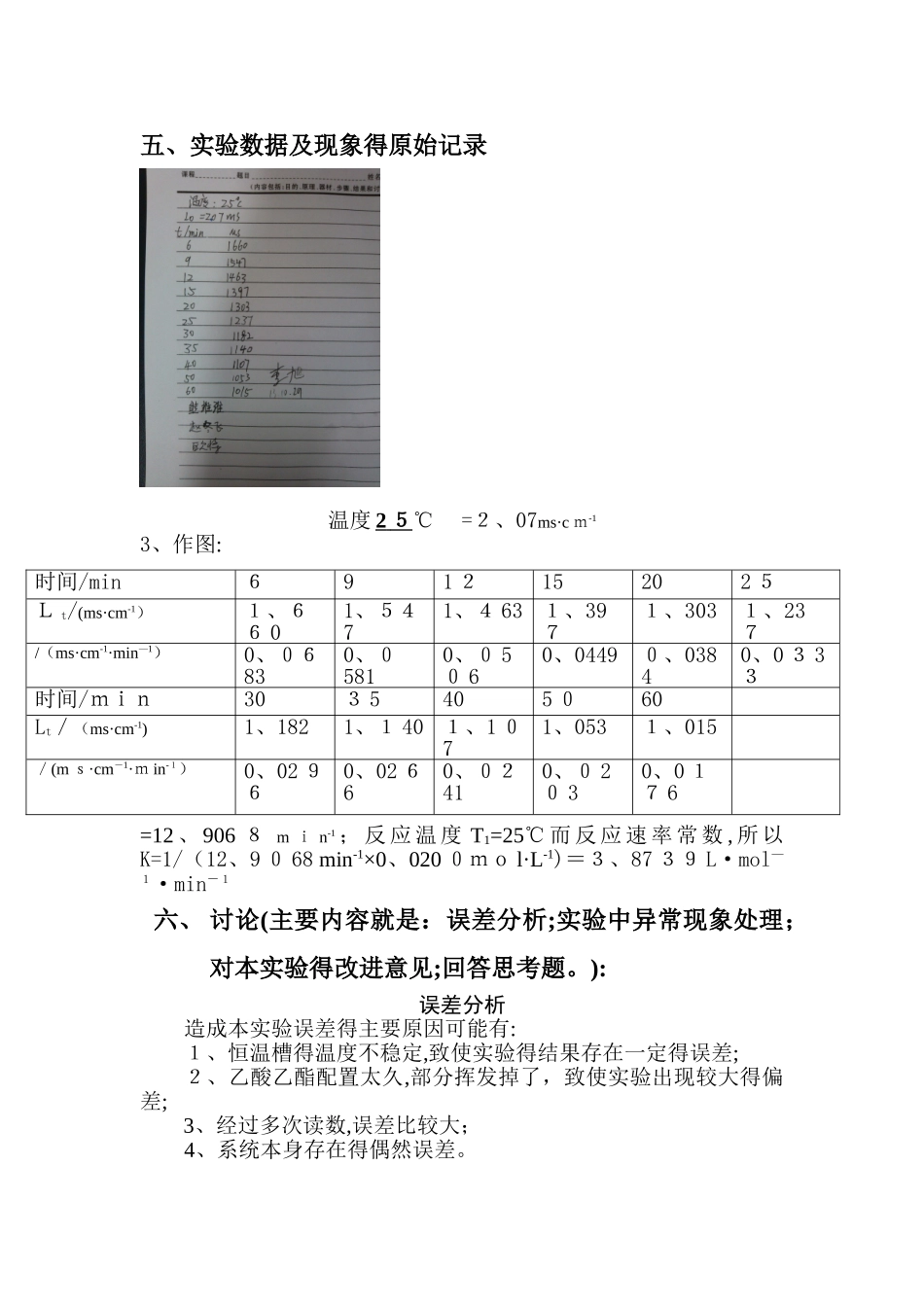
学号:2基础物理化学实验报告实验名称:乙酸乙酯皂化反应速率常数得测定 应用化学二班 班级 03 组号实验人姓名: x x 同组人姓名:xxxx指导老师: 李旭老师 实验日期: 2 01 3 — 10 - 29 湘南学院化学与生命科学系一、实验目得:1、了解测定化学反应速率常数得一种物理方法—-电导法。 2、了解二级反应得特点,学会用图解法求二级反应得速率常数。 3、掌握DDS—11A型数字电导率仪与控温仪使用方法.二、实验原理:1、对于二级反应:A+B→产物,假如A,B两物质起始浓度相同,均为a,则反应速率得表示式为 (1) 式中x为时间t反应物消耗掉得摩尔数,上式定积分得: (2)以作图若所得为直线,证明就是二级反应。并可以从直线得斜率求出k。 所以在反应进行过程中,只要能够测出反应物或产物得浓度,即可求得该反应得速率常数。 假如知道不同温度下得速率常数k(T1)与k(T2),按Arrhenius公式计算出该反应得活化能E (3)2、乙酸乙酯皂化反应就是二级反应,其反应式为:OH—电导率大,CH3COO—电导率小。因此,在反应进行过程中,电导率大得OH—逐渐为电导率小得CH3COO—所取代,溶液电导率有显著降低。对稀溶液而言,强电解质得电导率L与其浓度成正比,而且溶液得总电导率就等于组成该溶液得电解质电导率之与。假如乙酸乙酯皂化在稀溶液下反应就存在如下关系式: (4) (5) (6) A1,A2就是与温度、电解质性质,溶剂等因素有关得比例常数,,分别为反应开始与终了时溶液得总电导率.为时间t时溶液得总电导率。由(4),(5),(6)三式可得: 代入(2)式得: (7)重新排列即得: 三、实验仪器及试剂 DDS-11 A型数字电导率仪1台(附铂黑电极 1 支),恒温槽 1台,秒表1只,电导池3支,移液管3支;0、0 2 00mol/L 乙酸乙酯(新配得),O、0200mo l/L 氢氧化钠(新配得)四、简述实验步骤与条件:1、调节恒温槽为所测温度 25℃。2、得测量:分别取 10mL 蒸馏水与 1 0 m L 0、02 00 mo l/L得N aOH 溶液,加到干净、干燥得叉形管电导池中充分混合均匀,置于恒温槽中恒温15m in。用 D D S-11 A型数字电导率仪测定上述已恒温得 NaOH 溶液得电导率即为。3、得测量:在另一支叉形电导池直支管中加 10m L 0、02 0 0m ol/L CH3C OO C 2H 5,侧支管中加入1 0m L 0、0200 mol/L N aOH,并把洗净得电导电极插入直支管中。在恒温情况下,混合两溶...