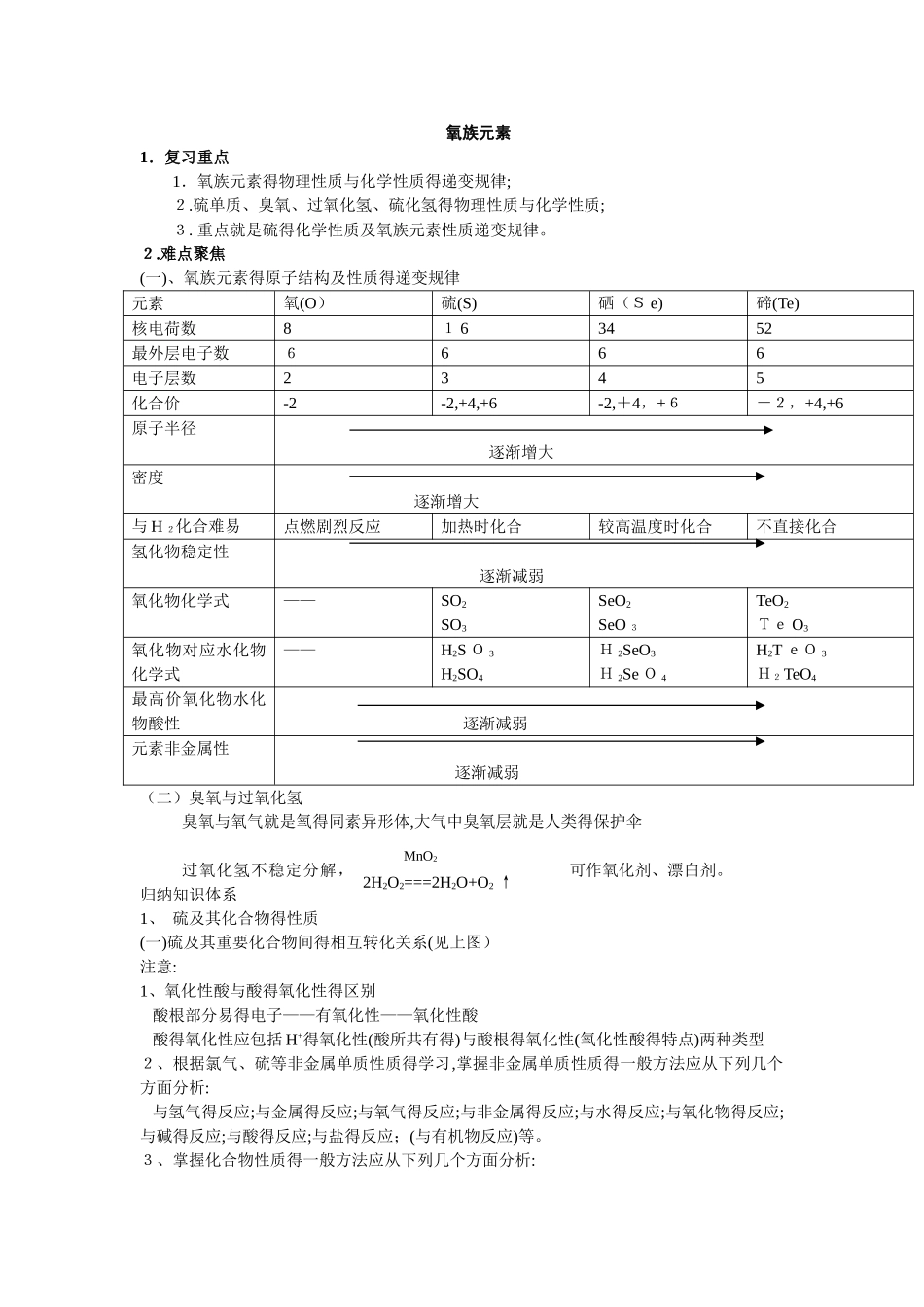
2H2O2===2H2O+O2 ↑MnO2氧族元素1.复习重点 1.氧族元素得物理性质与化学性质得递变规律;2.硫单质、臭氧、过氧化氢、硫化氢得物理性质与化学性质;3.重点就是硫得化学性质及氧族元素性质递变规律。2.难点聚焦(一)、氧族元素得原子结构及性质得递变规律元素氧(O)硫(S)硒(S e)碲(Te)核电荷数81 63452最外层电子数6666电子层数2345化合价-2-2,+4,+6-2,+4,+6-2,+4,+6原子半径逐渐增大密度 逐渐增大与 H 2化合难易点燃剧烈反应加热时化合较高温度时化合不直接化合氢化物稳定性 逐渐减弱氧化物化学式——SO2SO3SeO2SeO 3TeO2Te O3氧化物对应水化物化学式——H2S O 3H2SO4H 2SeO3H 2Se O 4H2T eO 3H2TeO4最高价氧化物水化物酸性 逐渐减弱元素非金属性 逐渐减弱(二)臭氧与过氧化氢臭氧与氧气就是氧得同素异形体,大气中臭氧层就是人类得保护伞过氧化氢不稳定分解,可作氧化剂、漂白剂。归纳知识体系1、 硫及其化合物得性质(一)硫及其重要化合物间得相互转化关系(见上图)注意:1、氧化性酸与酸得氧化性得区别 酸根部分易得电子——有氧化性——氧化性酸 酸得氧化性应包括 H+得氧化性(酸所共有得)与酸根得氧化性(氧化性酸得特点)两种类型2、根据氯气、硫等非金属单质性质得学习,掌握非金属单质性质得一般方法应从下列几个方面分析: 与氢气得反应;与金属得反应;与氧气得反应;与非金属得反应;与水得反应;与氧化物得反应;与碱得反应;与酸得反应;与盐得反应;(与有机物反应)等。3、掌握化合物性质得一般方法应从下列几个方面分析: 稳定性;可燃性;酸碱性;氧化性与还原性;特别性等。3.例题精讲[例 1]哪些实验事实说明氯元素得非金属性比硫元素强,并用原子结构知识加以解释。解析:目前,已学习过多种非金属元素,通过卤族、氧族元素得学习可得出,比较两种非金属元素得非金属性相对强弱一般可根据以下几方面得实验事实:① 非金属单质与 H2化合得难易以及氢化物得稳定性大小;② 最高价氧化物对应水化物得酸性强弱;③非金属单质间得置换反应。答案:可以说明氯元素非金属性比硫元素强得主要实验事实有:① 氯气与氢气反应时间照可发生爆炸,反应剧烈,硫单质加热变为蒸气才可与H2化合,且 H2S 不如 HC l稳定;②H 2SO 4得酸性不如 H C lO4强;③ H 2S与C l2反应可生成硫单质;④ 铁与Cl2反应生成F eCl 3,而硫与铁反应生成 FeS。S、Cl 两原子电子层数相同,但 Cl 原子最外层电子...