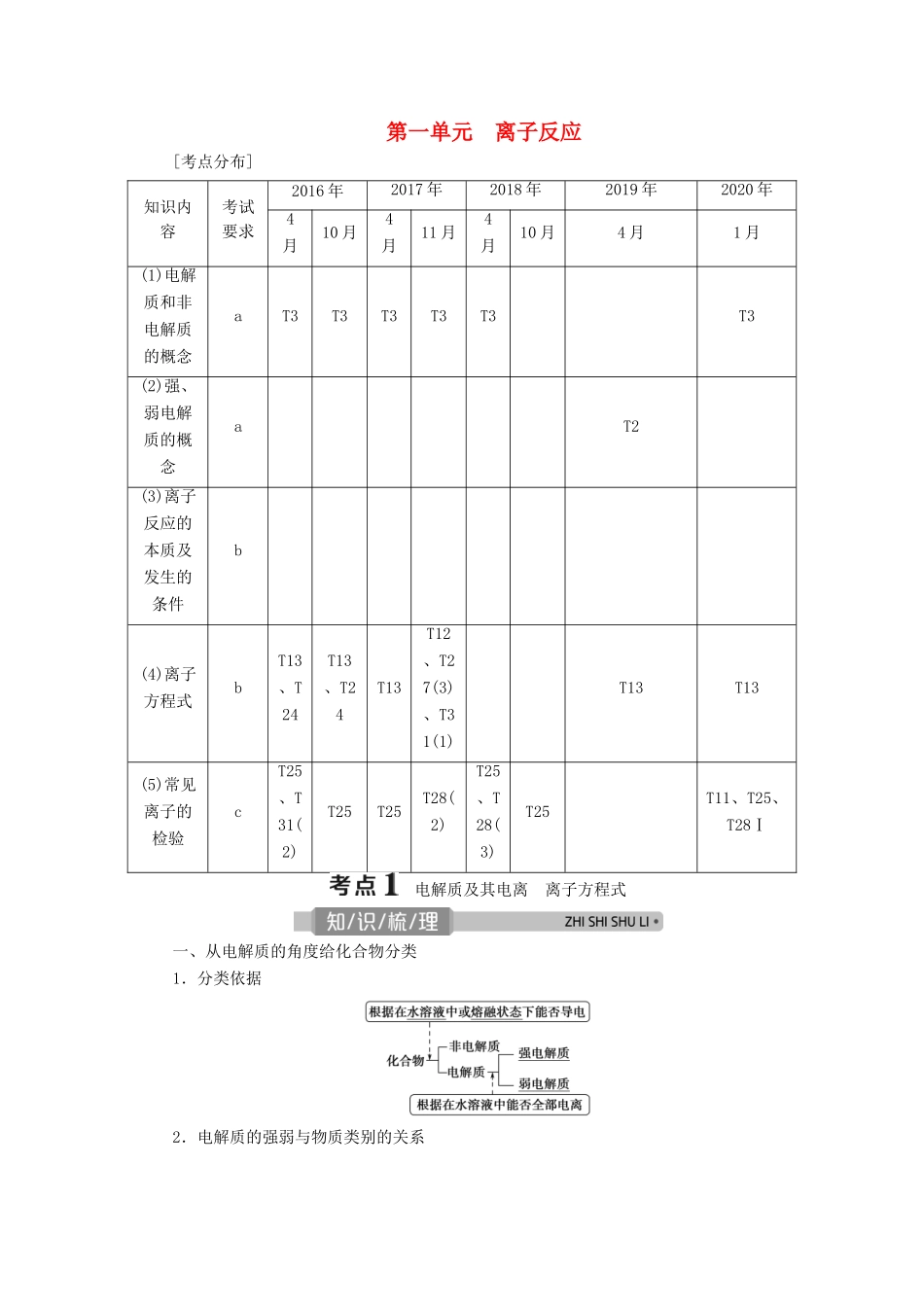
第一单元 离子反应[考点分布]知识内容考试要求2016 年2017 年2018 年2019 年2020 年4月10 月4月11 月4月10 月4 月1 月(1)电解质和非电解质的概念aT3T3T3T3T3T3(2)强、弱电解质的概念aT2(3)离子反应的本质及发生的条件b(4)离子方程式bT13、T24T13、T24T13T12、T27(3)、T31(1)T13T13(5)常见离子的检验cT25、T31(2)T25T25T28(2)T25、T28(3)T25T11、T25、T28Ⅰ 电解质及其电离 离子方程式一、从电解质的角度给化合物分类1.分类依据2.电解质的强弱与物质类别的关系3.电解质和非电解质的比较前提条件实验条件现象实质实例电解质化合物水溶液中或熔融状态下导电自身电离出离子HCl、CH3COOH、NaOH、BaSO4、NaCl、Na2O 等非电解质化合物水溶液中和熔融状态下都不导电自身不能电离出离子酒精、蔗糖、NH3、SO3、CO2等注意必须是化合物“或”与“和”的区别用“是否导电”不能确定是否为(非)电解质用“自身”能否电离,可确定是否为(非)电解质NH3、SO3等的水溶液能导电,但不是自身电离而导电,所以是非电解质4.强电解质和弱电解质的比较强电解质弱电解质电离程度完全部分电离平衡不存在存在溶液中微粒种类水合离子、水分子水合离子、水分子、弱电解质分子举例强酸、强碱、绝大部分盐(BaSO4、NaCl)、活泼金属氧化物(CaO)弱酸、弱碱、H2O、极少数盐相互关系均为电解质。在相同温度下,同浓度的强电解质溶液的导电能力强于弱电解质溶液二、电离及电离方程式1.电解质的电离电离是指电解质在水溶液中或熔融状态下产生自由移动离子的过程。2.电离方程式的书写(1)强电解质的电离方程式中,用“===”连接,弱电解质(包括弱酸的酸式酸根)的电离方程式中,用“”连接。如 Na2SO4:Na2SO4===2Na++SO,HClO:HClOH++ClO-。(2)多元弱酸的电离分步书写,多元弱碱的电离一步写完。如 H2CO3:H2CO3 H + + HCO,HCO H + + CO __;Fe(OH)3:Fe(OH)3 Fe 3 + + 3OH - 。(3)酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离情况不同。如 NaHSO4溶液中:NaHSO4== =Na + + H + + SO __;NaHCO3溶液中:NaHCO3== =Na + + HCO __、HCOH++CO。三、离子反应1.概念:有离子参加或有离子生成的反应统称为离子反应。2.离子反应的条件及本质在稀 H2SO4中分别加入下列物质,请写出有关的离子方程式:A.加入 BaCl2溶液:Ba 2 + + SO == =BaSO 4↓,B.加入 CH3COON...