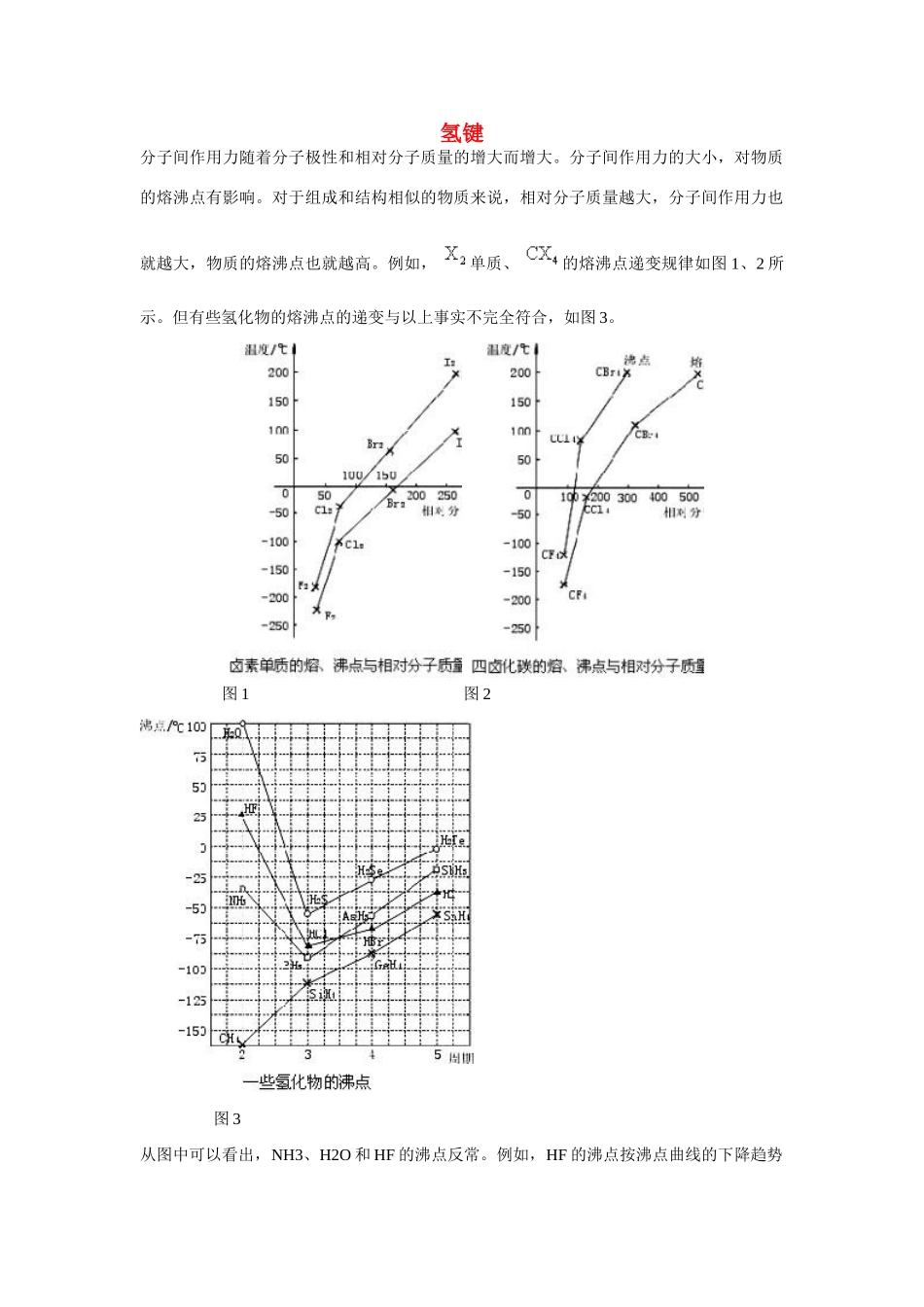
氢键分子间作用力随着分子极性和相对分子质量的增大而增大。分子间作用力的大小,对物质的熔沸点有影响。对于组成和结构相似的物质来说,相对分子质量越大,分子间作用力也就越大,物质的熔沸点也就越高。例如, 单质、 的熔沸点递变规律如图 1、2 所示。但有些氢化物的熔沸点的递变与以上事实不完全符合,如图 3。图 1图 2 图 3从图中可以看出,NH3、H2O 和 HF 的沸点反常。例如,HF 的沸点按沸点曲线的下降趋势应该在-90℃以下,而实际上是 20℃; H2O 的沸点按沸点曲线下降趋势应该在-70℃以下,而实际上是 100℃。为什么 HF、 H2O 和 NH3 的沸点会反常呢?这是因为它们的分子之间存在着一种比分子间作用力稍强的相互作用,使得它们只能在较高的温度下才能气化。经科学研究证明,上述物质的分子之间存在着的这种相互作用,叫做氢键。氢键是怎样形成的呢?现在以 HF 为例来说明。在 HF 分子中,由于 F 原子吸引电子的能力很强,H—F 键的极性很强,共用电子对强烈地偏向 F 原子,亦即 H 原子的电子云被 F 原子吸引,使 H 原子几乎成为“裸露”的质子。这个半径很小、带部分正电荷的 H 核,与另一个 HF 分子带部分负电荷的 F 原子相互吸引。这种静电吸引作用就是氢键。它比化学键弱得多,但比分子间作用力稍强。通常我们也可把氢键看作是一种比较强的分子间作用力。分子间形成的氢键会使物质的熔点和沸点升高,这是因为固体熔化或液体气化时必须破坏分子间的氢键,从而需要消耗较多能量的缘故。为了与化学键相区别,在图 4 中用“…”来表示氢键。 图 4 图 5结冰时体积膨胀,密度减小,是水的另一反常性质,也可以用氢键来解释。在水蒸气中水是以单个的 H2O 分子形式存在的;在液态水中,经常以几个水分子通过氢键结合起来,形成( H2O)n(如图 5);在固态水(冰)中,水分子大范围地以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上水的这种性质对于水生动物的生存有重要意义。氢键可分为分子间氢键与分子内氢键两大类。一个分子的 X—H 键与另一个分子的 Y 相结合而成的氢键,称为分子间氢键。例如,水、甲酸、乙酸等缔合体就是通过分子间氢键而形成的。除了这种同类分子间的氢键外,不同分子间也可形成氢键,例如:根据红外光谱的研究结果,表明分子间氢键一般是成直线型(其理由见前面氢键的方向性的论述)。由于这样...