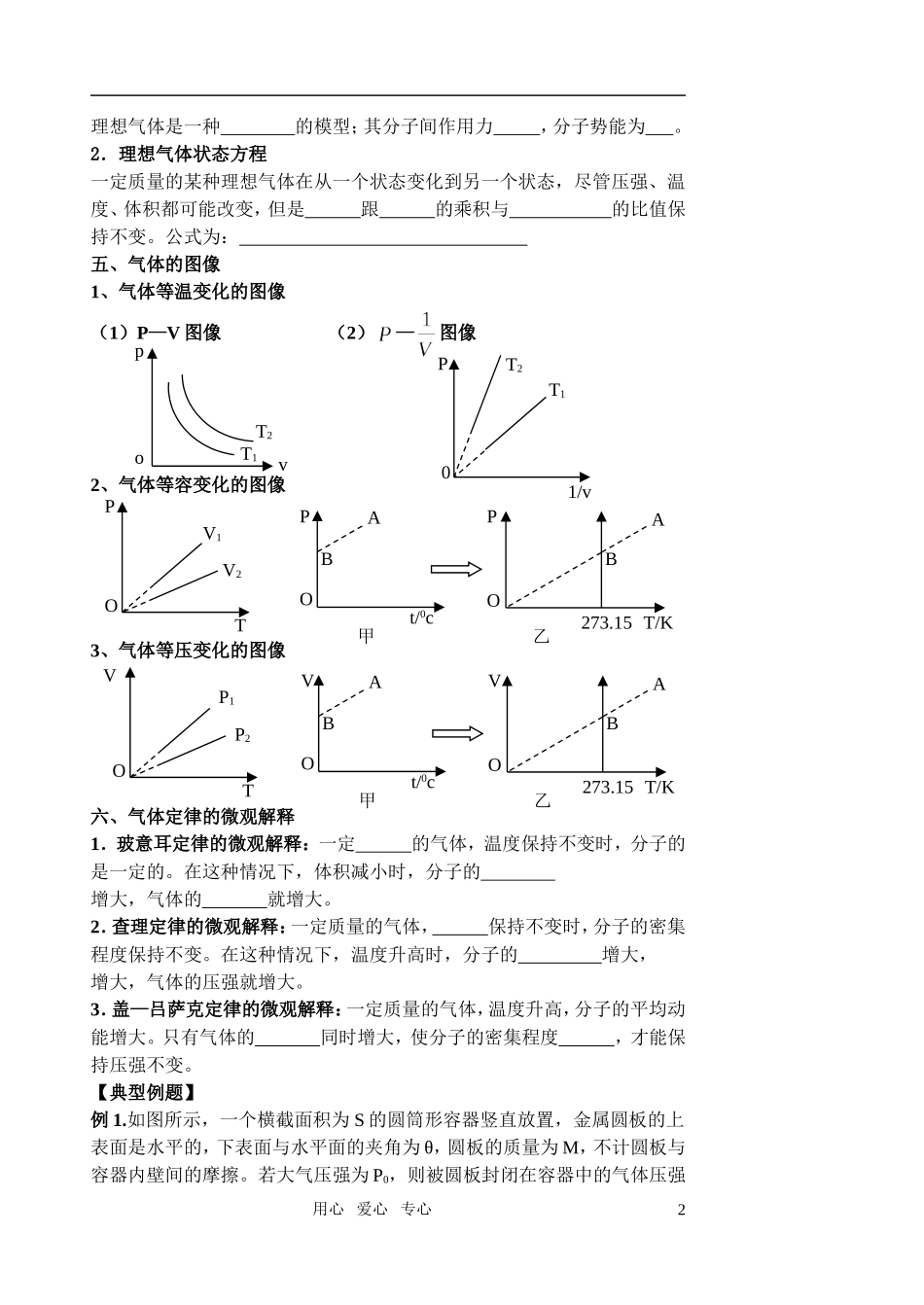
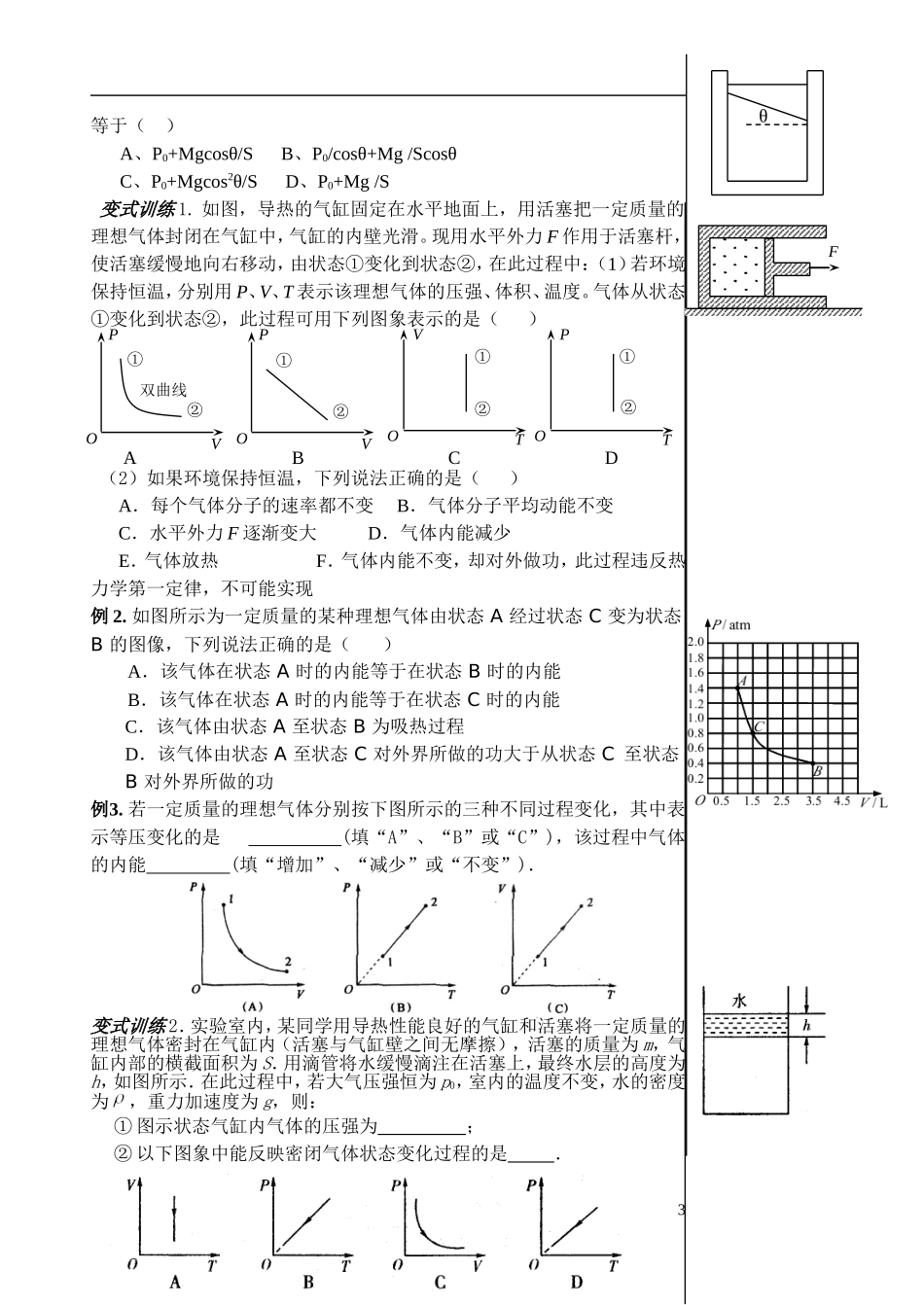
气 体【学习目标】1、知道气体的状态参量;知道气体热现象的微观意义。2、知道玻意耳、查理、盖—吕萨克定律及其等温、等容、等压变化的图像。(重点)3、知道理想气体模型、理想气体的状态方程;不要求用气体实验定律进行定量计算。【知识要点】一、描述气体的状态参量1、温度:略2、体积:① 宏观上:容纳气体的 .②微观上:气体分子所能达到的 . ③单位:国际单位为 ,且 1 m3=103 dm3=106 cm3.3、压强① 气体压强的产生原因:气体的压强是 分子 地碰撞器壁产生的,单个分子碰撞器壁的冲力是短暂的,但大量分子频繁地碰撞器壁,对器壁就产生了持续、均匀的压力,气体的压强在数值上等于大量气体分子作用在器壁 面积上的平均作用力。② 国际单位为 ,符号为 ,且 1atm=1.013×105 Pa=76 cmHg.③ 大小决定因素:宏观上:气体的 和物质的量.微观上:单位体积内的分子数和 .二、气体分子动理论1、气体分子运动的特点:由于气体分子间距大,气体分子的大小可以忽略,分子间的作用力很小,也可以忽略.因此,除分子间及分子与器壁间碰撞外,分子间无相互作用力,所以不计 .气体的内能只与气体的物质的量和 有关,分子处于自由运动状态.2、气体分子运动的统计规律① 气体分子沿各个方向运动的机会(机率) .② 大量气体分子的速率分布呈现 (中等速率的分子数目多)、 (速率大或数目少)的规律.③ 当温度升高时,“中间多”的这一“高峰”向 的一方移动,即速率大的分子数目增多,速率小的分子数目减小,分子的平均速率 ,但不是每个气体分子的速率均增大. 三、气体定律1.玻意耳定律:一定质量的某种气体,在 不变的情况下, 与 成反比。公式为 或 P1V1= 。2.查理定律:一定质量的某种气体,在 不变的情况下, 与 成正比。公式为 P= 或 P1/P2= 。2.盖—吕萨克定律:一定质量的某种气体,在 不变的情况下, 与 成正比。公式为 V= 或 V1/V2= 。四、理想气体状态方程1.理想气体:在 和 下都能遵从气体实验定律的气体。用心 爱心 专心1理想气体是一种 的模型;其分子间作用力 ,分子势能为 。2.理想气体状态方程一定质量的某种理想气体在从一个状态变化到另一个状态,尽管压强、温度、体积都可能改变,但是 跟 的乘积与 的比值保持不变。公式为: 五、气体的图像1、气体等温变化的图像(1)P—V 图像 (2)—图像2、气体等容变化的图像3、气体等压变化的图像六、气体定律...