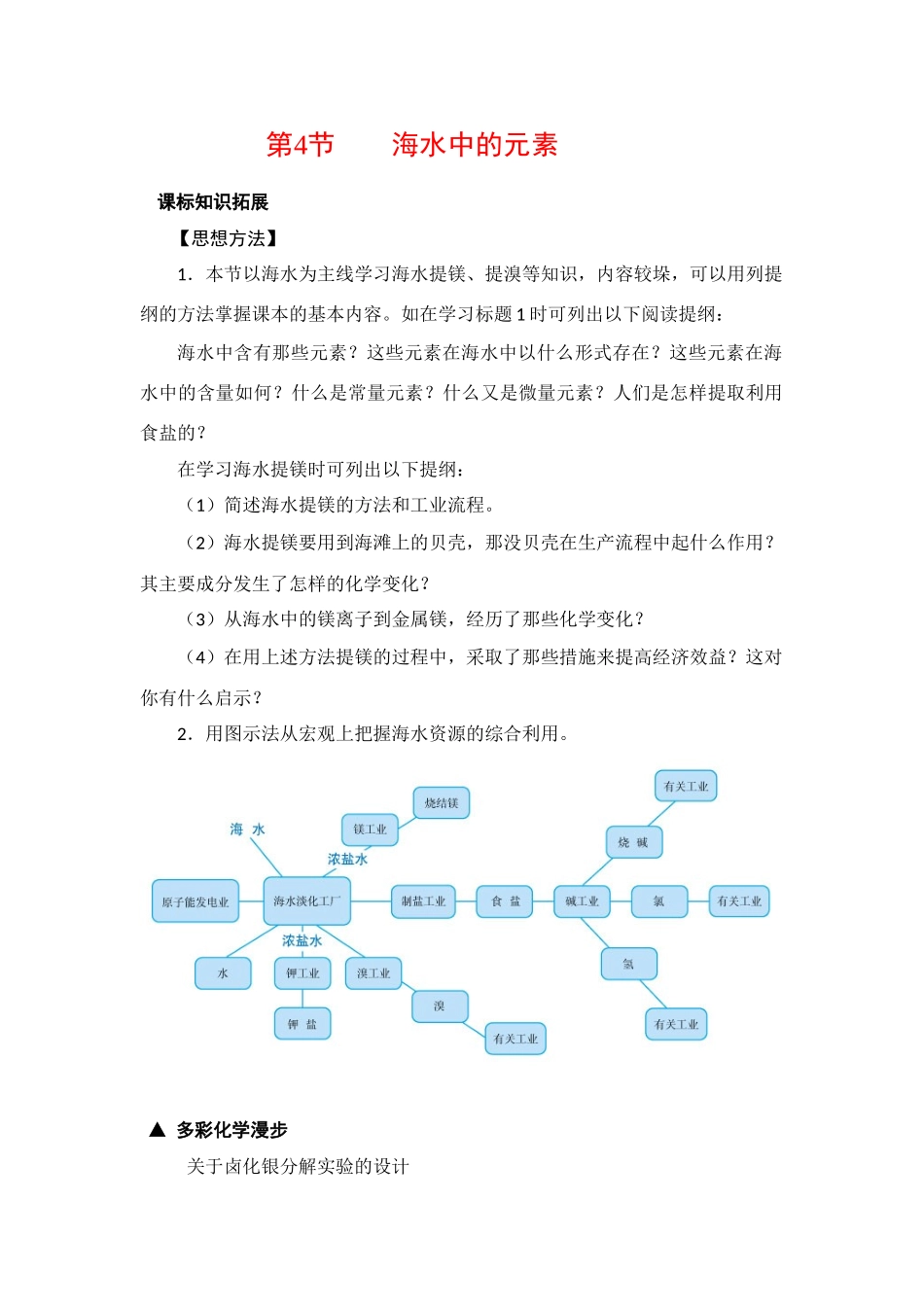
第4节海水中的元素 课标知识拓展【思想方法】1.本节以海水为主线学习海水提镁、提溴等知识,内容较垛,可以用列提纲的方法掌握课本的基本内容。如在学习标题 1 时可列出以下阅读提纲:海水中含有那些元素?这些元素在海水中以什么形式存在?这些元素在海水中的含量如何?什么是常量元素?什么又是微量元素?人们是怎样提取利用食盐的?在学习海水提镁时可列出以下提纲:(1)简述海水提镁的方法和工业流程。(2)海水提镁要用到海滩上的贝壳,那没贝壳在生产流程中起什么作用?其主要成分发生了怎样的化学变化?(3)从海水中的镁离子到金属镁,经历了那些化学变化?(4)在用上述方法提镁的过程中,采取了那些措施来提高经济效益?这对你有什么启示?2.用图示法从宏观上把握海水资源的综合利用。▲ 多彩化学漫步关于卤化银分解实验的设计有关卤化银的感光性,可按以下方法来进行实验:试剂和仪器: 0.1 mol·L-1的 NaCl、NaBr、KI 溶液,2%的 AgNO3溶液。500 mL 圆底烧瓶、大烧杯、聚光电筒。实验步骤:(1)将 3 只预先注有 4/5 容积蒸馏水的圆底烧瓶用大烧杯垫托安置于讲台上,使之处于较好的视觉高度,编号。(2)依次往上述烧瓶中加入 2 至 5 mL NaCl、NaBr 和 KI 溶液,振荡摇匀。(3)慢慢地往烧瓶中滴加 AgNO3溶液,边滴边振荡,可三名同学同时操作,3 种胶体同时制作,便于比较。注意观察胶体形成的效果,要求胶体颜色明显,无浑浊状态。(4)胶体制备好后,记录时间,用聚光电筒进行爆光(或置于阳光下),观察分解反应的速度及颜色等现象的变化,做好记录。结论:分解速率:在同样光照条件下,AgBr 分解最快,先由浅黄色透明状变成灰黑色浑浊态,时间约 2 min;AgCl 次之,由乳白透明状变成灰白浑浊态;AgI 最慢,较长时间才略有变化。问题:1.你认为本实验有何优点?2.18 世纪 70 年代.瑞典化学家舍勒在研究一种白色、难溶于水的盐时发现,在黑暗中此盐并无气味,而在光照时开始变黑并有刺激性气味的气体产生。此盐是A.氟化银 A.氯化银 C.溴化银 D.碘化银 1.答案:本实验操作简便,所需时间短,效果明显,反映了光对本组实验的作用,说明了光及试剂对化学效应的影响,解决了 AgX 光解反应速率变化规律,在相同条件下,AgX 的光解速率是:AgBr>AgCl>AgI。这也解释了工业上以 AgBr 明胶粒作为胶卷感光材料的原因。这对激发同学们勇于探求化学奥秘的热情,起到了一定的作用。本...